
 绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 该反应的正反应是放热反应
绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 该反应的正反应是放热反应
 2Z+2W 增大X.(g)浓度,平衡向逆反应方向移动
2Z+2W 增大X.(g)浓度,平衡向逆反应方向移动
 该反应的正反应是吸热反应 增大CO2浓度,平衡常数增大
该反应的正反应是吸热反应 增大CO2浓度,平衡常数增大
 CO2(g)+H2(g) 上述反应的正反应是放热反应 如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO为0.4 mol时,该反应为平衡状态 某温度下,如果平衡浓度符合下列关系式:
CO2(g)+H2(g) 上述反应的正反应是放热反应 如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO为0.4 mol时,该反应为平衡状态 某温度下,如果平衡浓度符合下列关系式: =
=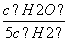 ,判断此时的温度是1000 ℃
,判断此时的温度是1000 ℃
 该反应的化学平衡常数表达式为K.= 绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 该反应的正反应是放热反应
该反应的化学平衡常数表达式为K.= 绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 该反应的正反应是放热反应
 绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 该反应的正反应是放热反应
绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 该反应的正反应是放热反应

 增大压强其平衡常数不变,但使平衡向生成Z的方向移动 改变温度可以改变此反应的平衡常数
增大压强其平衡常数不变,但使平衡向生成Z的方向移动 改变温度可以改变此反应的平衡常数

 2Z+2W 增大X.(g)浓度,平衡向逆反应方向移动
2Z+2W 增大X.(g)浓度,平衡向逆反应方向移动
 CO2(g)+H2(g) 上述反应的正反应是放热反应 若在1L的密闭容器中通入CO2和H2各1mol,5min后温度升高到830℃,此时测得CO2为0.4mol时,该反应达到平衡状态 若平衡浓度符合下列关系式:
CO2(g)+H2(g) 上述反应的正反应是放热反应 若在1L的密闭容器中通入CO2和H2各1mol,5min后温度升高到830℃,此时测得CO2为0.4mol时,该反应达到平衡状态 若平衡浓度符合下列关系式: ,则此时的温度为1000℃
,则此时的温度为1000℃
 2Z+2W 增大X.(g)浓度,平衡向逆反应方向移动
2Z+2W 增大X.(g)浓度,平衡向逆反应方向移动
 该反应的正反应是吸热反应 增大CO2浓度,平衡常数增大
该反应的正反应是吸热反应 增大CO2浓度,平衡常数增大