
 A. 10 s时反应生成了0.2 molC. B. 该反应进行到10 s时,消耗了0.15 molA. C. 该反应的化学方程式为3A+B.===2C 10 s内用B.表示的反应速率为0.01 mol·L-1·s-1
A. 10 s时反应生成了0.2 molC. B. 该反应进行到10 s时,消耗了0.15 molA. C. 该反应的化学方程式为3A+B.===2C 10 s内用B.表示的反应速率为0.01 mol·L-1·s-1
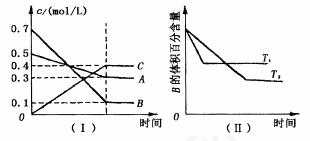 A.在(t1+10)min时,保持其它条件不变,增大压强,平衡逆向移动 B.其它条件不变,升高温度,A.的转化率一定增大 C.T.℃时,若由0.4mol/LA.0.4mol/LB.和0.2mol/LC.反应,达到平衡后,c(C.)仍为0.4mol/L. (t1+10) min时,保持压强不变,通入稀有气体,平衡向正反应方向移动
A.在(t1+10)min时,保持其它条件不变,增大压强,平衡逆向移动 B.其它条件不变,升高温度,A.的转化率一定增大 C.T.℃时,若由0.4mol/LA.0.4mol/LB.和0.2mol/LC.反应,达到平衡后,c(C.)仍为0.4mol/L. (t1+10) min时,保持压强不变,通入稀有气体,平衡向正反应方向移动
 。下列叙述不正确的是( )A.反应过程中容器内气体的压强减小至不变 B.反应过程中混合气体的颜色由无色变深C.混合气体的密度始终不变 充分反应后容器内最多含有二种气体
。下列叙述不正确的是( )A.反应过程中容器内气体的压强减小至不变 B.反应过程中混合气体的颜色由无色变深C.混合气体的密度始终不变 充分反应后容器内最多含有二种气体
 2C B.在t1~(t1+10)s时,vA.=vB.=0 C.t1 s时反应物A.的转化率为60% 0~t1 s内A.的反应速率为vA.=
2C B.在t1~(t1+10)s时,vA.=vB.=0 C.t1 s时反应物A.的转化率为60% 0~t1 s内A.的反应速率为vA.= mol/(L·s)
mol/(L·s)
 A.10 s时反应生成了0.2 mol C. B.该反应进行到10 s时,消耗了0.15 molA. C.该反应的化学方程式为3A+B.
A.10 s时反应生成了0.2 mol C. B.该反应进行到10 s时,消耗了0.15 molA. C.该反应的化学方程式为3A+B. 2C 10 s内用B.表示的反应速率为0.01 mol·L.-1·s-1
2C 10 s内用B.表示的反应速率为0.01 mol·L.-1·s-1
 A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动 B.在(t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向正反应方向移动 C.T.℃时,在相同容器中,若由0.3mol·L—1 A. 、0.1 mol·L—1B.和0.4 mol·L—1C.反应,达到平衡后,C.的浓度仍为0.4 mol·L—1 其他条件不变,升高温度,正、逆反应速率均增大,且A.的转化率增大
A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动 B.在(t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向正反应方向移动 C.T.℃时,在相同容器中,若由0.3mol·L—1 A. 、0.1 mol·L—1B.和0.4 mol·L—1C.反应,达到平衡后,C.的浓度仍为0.4 mol·L—1 其他条件不变,升高温度,正、逆反应速率均增大,且A.的转化率增大
 则下列结论正确的是( ) A.该反应的化学方程式是A.+3B═2C B.该反应的正反应为放热反应 C.定容条件下,混合气体的密度不再变化,则证明该反应达到平衡 压强增大,则该反应的正反应速率增大,逆反应速率减小
则下列结论正确的是( ) A.该反应的化学方程式是A.+3B═2C B.该反应的正反应为放热反应 C.定容条件下,混合气体的密度不再变化,则证明该反应达到平衡 压强增大,则该反应的正反应速率增大,逆反应速率减小