你可能感兴趣的试题
两种分子的中心原子杂化类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 NH3分子中N.原子形成3个杂化轨道,CH4分子中 原子形成4个杂化轨道 C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 NH3分子中有3个σ键,而甲烷分子中有4个 σ键
sp3杂化 sp杂化 sp2杂化 sp3不等性杂化
正四面体,sp3杂化 三角锥形,不等性sp3杂化 正方形,dsp2杂化 正三角形,sp2杂化
凡是中心原子采取sp3杂化的分子,其立体构形都是正四面体 CH4分子中的sp3杂化轨道是由4个H.原子的1s轨道和 原子的2p轨道混合起来而形成的 C.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对 凡AB3型的共价化合物,其中心原子A.均采用sp3杂化轨道成键
sp3杂化 sp杂化 sp2杂化 sp3不等性杂化
两种分子的中心原子杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3杂化 NH3分子中N.原子形成3个杂化轨道,CH4分子中 原子形成4个杂化轨道 C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 NH3分子中有3个σ键,而CH4分子中有4个σ键
sp2杂化;sp2杂化 sp3杂化;sp3杂化 sp2杂化;sp3杂化 sp1杂化;sp3杂化
N原子采取sp2杂化,键角为l07.3 N原子采取sp3杂化,包含一条d键三条丌键,键角l07.3 N原子采取sp3杂化,包含一条d键二条Ⅱ键,键角l09.5° N原子采取不等性sp3杂化,分子构形为三角锥形,键角107.3℃
N原子采取SP2杂化,键角为107.3°; N原子采取SP3杂化,包含一条σ键三条π键,键角107.3°; N原子采取SP3杂化,包含一条σ键二条π键,键角109.5°; N原子采取不等性SP3杂化,分子构形为三角锥形,键角107.3°
乙烯分子中碳原子的sp2杂化轨道形成σ键,未参与杂化的2p轨道形成π键
乙烯分子中碳原子的sp2杂化轨道形成π键,未参与杂化的2p轨道形成σ键
乙炔分子中两个碳原子采用sp1杂化方式,未参与杂化的2p轨道形成π键
乙炔分子中两个碳原子采用sp2杂化方式,未参与杂化的2p轨道形成σ键
NH3 平面三角形 sp3杂化 CCl4 正四面体 sp3杂化 H2OV.形 sp2杂化 CO32- 三角锥形 sp3杂化
sp3杂化 sp杂化 sp2杂化 sp3不等性杂化
sp3杂化 sp杂化 sp2杂化 sp3不等性杂化
杂化前后的轨道数不变,但轨道的形状发生了改变 sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180° 四面体形、三角锥形、V.形分子的结构可以用sp3杂化轨道解释 杂化轨道全部参加形成化学键
两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 NH3为三角锥形,甲烷是正四面体形 NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较弱 NH3和CH4都是sp3型杂化,键角都是109°28′
NH 4+ CH 4 H 2 O BeCI 2 BF 3
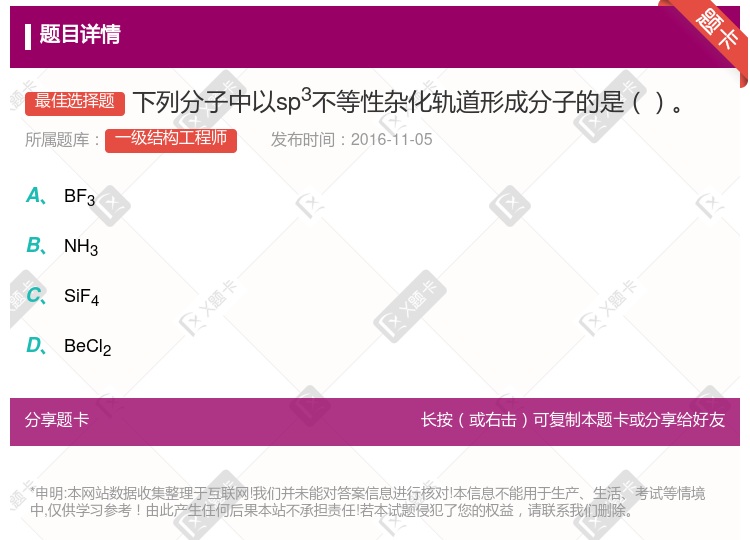
 杂化 sp
杂化 sp 杂化 sp
杂化 sp 不等性杂化
不等性杂化
 SiF
SiF BF
BF BeCl
BeCl