
 mol/L
mol/L 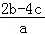 mol/L
mol/L  mol/L
mol/L 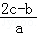 mol/L
mol/L
 mol.l-1
mol.l-1  mol.l-1
mol.l-1  mol.l-1
mol.l-1  mol.l-
mol.l-
 mol.l-1
mol.l-1 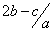 mol.l-1
mol.l-1  mol.l-1
mol.l-1 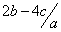 mol.l-
mol.l-
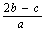 mol/L
mol/L  mol/L
mol/L  mol/L
mol/L  mol/L
mol/L
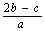 mol/L
mol/L  mol/L
mol/L 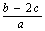 mol/L
mol/L  mol/L
mol/L