你可能感兴趣的试题
常温下,等浓度、等体积的NaHCO3 溶液pH小于 溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和
溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和  溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者  水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
HF的电离常数是① HNO2的电离常数是① HCN的电离常数是② HNO2的电离常数是③
等物质的量浓度的各溶液pH关系为pH(CH3COOH)>pH(H2C2O4)>pH(HCN) a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液不可能呈碱性 向Na2C2O4溶液中滴加足量HCN溶液产生二氧化碳气体 H2C2O4能使酸性高锰酸钾溶液褪色
有一个滴定突跃,可滴定第一、二级电离的H+总和,但第一、二级电离不可分步滴定 有两个滴定突跃,第一、二级电离可分步滴定 没有明显的滴定突跃 有一个滴定突跃,第一级电离的H+可被滴定,第二级电离的H+不能被滴定
电离平衡常数越小,表示弱电解质的电离能力越弱 电离平衡常数与温度无关 不同浓度的同一弱电解质,其电离平衡常数不同 多元弱酸各步电离平衡常数相互关系为:K1〈K2〈K3
不同浓度的同一弱电解质,其电离平衡常数(K.)不同 电离平衡常数(K.)越小,表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K.1<K.2<K.3 CH3COOH溶液中加入少量CH3COONa溶液,电离常数减小
电离常数越小,表示弱电解质的电离能力越弱 电离常数与温度无关 不同浓度的同一弱电解质,其电离常数不同 多元弱酸各步电离常数相互关系K1<K2<K3
CH3COONa NaClO Na2CO3 Na3PO4
纯水它能微弱的电离出H+和OH- 25℃时,纯水电离出的H+和OH-浓度相等 25℃时,水的离子积常数为1³10-14 25℃时,水的离子积常数为1³10-7
电离常数越小,pH值越低 电离常数越小,pH值越高 不论弱酸的电离常数多大,pH值一定
常温下,等浓度、等体积的NaHCO3 溶液pH小于 溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和
溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和 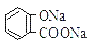 溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者 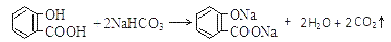 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
电离平衡常数(K.)与温度无关 H2CO3的电离常数表达式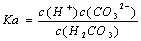 同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K123
同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K123
碳酸的酸性强于氢硫酸 多元弱酸的酸性主要由第一步电离决定 多元弱酸的各步电离之间无影响 向弱酸溶液中加少量NaOH固体,电离常数不变
常温下,同物质的量浓度NaClO与NaHCO3溶液,前者的pH较小 若某溶液中c(F—)=c(ClO—),往该溶液中滴入HCl,F-比ClO-更易结合H+ 往饱和Na2CO3溶液中逐滴加入稀盐酸至过量,所得溶液中c(HCO3—)先增大后减小 同温下,等体积、等pH的HF和HClO分别与NaOH完全反应,消耗等量的NaOH
电离常数(K.)越小,表示弱电解质电离能力越弱 电离常数(K.)与温度无关 不同浓度的同一弱电解质,其电离常数(K.)不同 多元弱酸各步电离常数相互关系为K.123
等物质的量浓度的各溶液pH关系为:pH(CH3COONa)> pH(Na2S) > pH(NaCN) a mol/LHCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) 某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L
 溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和
溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和  溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者  水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
 溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和
溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和 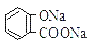 溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者 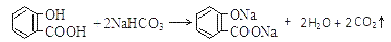 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
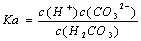 同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K1
同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K1