你可能感兴趣的试题
①式表示负极反应,②式表示正极反应 铅蓄电池的电解质溶液是硫酸溶液,在放电过程中,它的浓度逐渐降低 铅蓄电池在放电时,电子从Pb通过导线流向PbO2 铅蓄电池在充电时,原来负极发生的反应是:Pb+SO42―–2e―=PbSO4
放电时,溶液中H+向PbO2电极迁移
放电时,电路中转移0.2mol电子时Pb电极质量减小20.7g
充电时,电解质溶液的pH增大
充电时,阴极的电极反应式为:PbSO4+2H2O-2e-=PbO2+4H++SO42-
PbO2得电子,被氧化 铅蓄电池工作过程中每通过2mol电子,负极质量减少207g 电池放电时,电流是由PbO2经外电路流向Pb 电池放电时,溶液酸性增强
PbO2是电源的负极 负极的电极反应式为:Pb+SO42- -2e- =PbSO4 电池放电时,溶液的pH增大 电池放电时,PbO2得电子,被氧化
PbO2是电池的负极 负极的电极反应式为:Pb(s)+SO42(aq)–2e – = PbSO4(s) 铅蓄电池属于一次电池 电池放电时,溶液酸性增强
PbO2是电池的负极 负极的电极反应式为:Pb + SO42- 2e == PbSO4 PbO2得电子,被氧化 电池放电时,溶液酸性增强
放电时PbO2为正极,反应的离子方程式为:PbO2+4H++2e-+SO42-===PbSO4+2H2O 充电时Pb电极为阴极,反应的离子方程式为:PbSO4+2e-===Pb+SO42- 放电时电解质溶液密度不断减小,可根据电解液密度来判断是否需要充电 充电时可直接使用交流电源,不需要充电器也可充入
PbO2是电池的负极 负极的电极反应式为:Pb(s)+SO42-(aq)–2e – = PbSO4(s) 铅蓄电池属于一次性电池 电池放电时,溶液酸性增强
PbO2是电池的负极 负极的电极反应式为:Pb + SO – 2e – = PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强
– 2e – = PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强
PbO2是电池的负极 负极的电极反应式为:Pb+SO –2e–=PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强
–2e–=PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强
放电时:当外电路通过1mol的电子时,理论上负极板的质世增加了151.5g 充电时:阳极反应是PbSO4→2e-+2 H2O =PbO2+ SO42-+4H+ 放电时:正极反应是Pb-2e-+ SO42-= PbSO4 充电时:铅蓄电池的阴极应与电源的正极相连
Pb为正极,PbO2为负极 正极电极反应式为PbO2 + SO4 2- + 2H+ == PbSO4 + H2O 硫酸溶液中,H+移向负极 放电一段时间后,SO4 2-浓度减小
放电时,负极反应为:PbO2+4H++2e一=Pb2++2H2O
充电时,当阳极质量增加23.9g时转移0.4mol电子
放电时,正极区电解质溶液的pH.增大
充电时,Pb电极与电源的正极相连
放电时Pb为负极 充电时阳极的电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42- 放电完全后铅蓄电池可进行充电,此时铅蓄电池的负极连接外电源的正极 用铅蓄电池电解CuCl2溶液,若制得2.24L Cl2(标准状况),这时电池内至少转移 0.2 mol电子
PbO2是电池的负极 负极的电极反应式为:Pb + SO42-- 2e - = PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强
PbO2是电池的负极 负极的电极反应式为:Pb(s)+SO42-(aq)–2e – = PbSO4(s) 铅蓄电池属于一次电池 电池放电时,溶液酸性增强
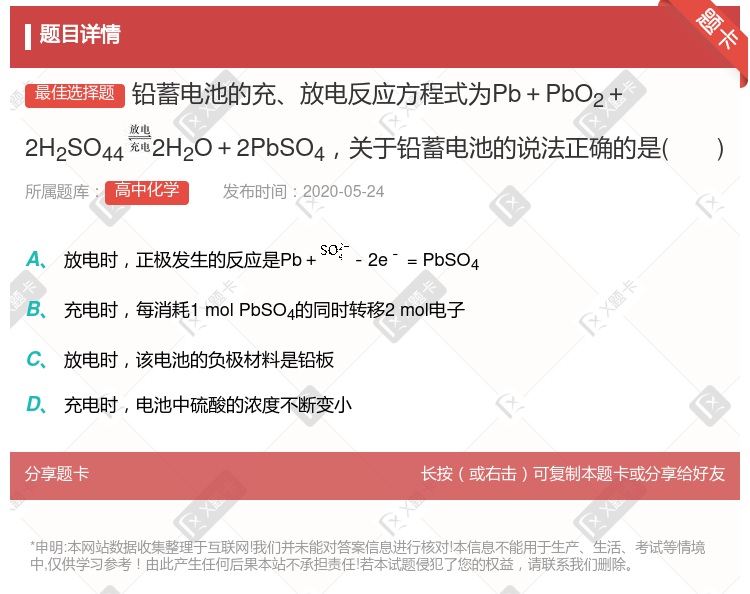
 – 2e – = PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强
– 2e – = PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强
 –2e–=PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强
–2e–=PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强