你可能感兴趣的试题
①式表示负极反应,②式表示正极反应 铅蓄电池的电解质溶液是硫酸溶液,在放电过程中,它的浓度逐渐降低 铅蓄电池在放电时,电子从Pb通过导线流向PbO2 铅蓄电池在充电时,原来负极发生的反应是:Pb+SO42―–2e―=PbSO4
PbO2放电时是电池的负极,充电时是电池的阳极。 负极的电极反应式为:Pb + SO – 2e – = PbSO4 放电时,PbO2得电子,被氧化 电池放电时,溶液酸性增强
– 2e – = PbSO4 放电时,PbO2得电子,被氧化 电池放电时,溶液酸性增强
放电时,负极质量增加  充电时,应将外接直流电源的正极与蓄电池的铅电极相接 放电时,正极反应为: 铅蓄电池做电源电解Na2SO4溶液时,当有lmolO2产生时,消耗4molH2SO4
充电时,应将外接直流电源的正极与蓄电池的铅电极相接 放电时,正极反应为: 铅蓄电池做电源电解Na2SO4溶液时,当有lmolO2产生时,消耗4molH2SO4
PbO2是电源的负极 负极的电极反应式为:Pb+SO42- -2e- =PbSO4 电池放电时,溶液的pH增大 电池放电时,PbO2得电子,被氧化
PbO2是电池的负极 负极的电极反应式为:Pb(s)+SO42(aq)–2e – = PbSO4(s) 铅蓄电池属于一次电池 电池放电时,溶液酸性增强
PbO2是电池的负极 负极的电极反应式为:Pb + SO42- 2e == PbSO4 PbO2得电子,被氧化 电池放电时,溶液酸性增强
PbO2是电池的负极 负极的电极反应式为:Pb + SO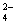 - 2e—
- 2e—  PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强
PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强
充电时电源的正极接蓄电池标“+”的一极 “无液干粉”铅酸蓄电池彻底改变了原来的铅酸蓄电池的原理 放电时在铅酸蓄电池的负极发生还原反应 充电时电池上标有“―”的极发生氧化反应
PbO2是电池的负极 负极的电极反应式为:Pb + SO – 2e – = PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强
– 2e – = PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强
PbO2是电池的负极 放电时,溶液中的H+ 向正极区移动 ,正极区域的溶液的酸性增强 放电时,电子由Pb 极通过导线流向 PbO2 正极的电极反应式为Pb-2e-=Pb2+
PbO2是电池的负极 负极的电极反应式为:Pb+SO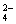 –2e–=PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强
–2e–=PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强
1.7~1.8 1.5~1.6 1.4~1.5 1.3~1.4
PbO2是电池的负极 负极的电极反应式为:Pb + SO42-- 2e - = PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强
PbO2是电池的负极 负极的电极反应式为:Pb(s)+SO42-(aq)–2e – = PbSO4(s) 铅蓄电池属于一次电池 电池放电时,溶液酸性增强
Pb02是电池的负极 负极的电极反应式为:Pb+SO42--2e-=PbSO4 PbO2得电子,被氧化 电池放电时,溶液酸性增强

 – 2e – = PbSO4 放电时,PbO2得电子,被氧化 电池放电时,溶液酸性增强
– 2e – = PbSO4 放电时,PbO2得电子,被氧化 电池放电时,溶液酸性增强
 充电时,应将外接直流电源的正极与蓄电池的铅电极相接 放电时,正极反应为: 铅蓄电池做电源电解Na2SO4溶液时,当有lmolO2产生时,消耗4molH2SO4
充电时,应将外接直流电源的正极与蓄电池的铅电极相接 放电时,正极反应为: 铅蓄电池做电源电解Na2SO4溶液时,当有lmolO2产生时,消耗4molH2SO4
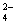 - 2e—
- 2e—  PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强
PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强
 – 2e – = PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强
– 2e – = PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强
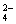 –2e–=PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强
–2e–=PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强