你可能感兴趣的试题
①式表示负极反应,②式表示正极反应 铅蓄电池的电解质溶液是硫酸溶液,在放电过程中,它的浓度逐渐降低 铅蓄电池在放电时,电子从Pb通过导线流向PbO2 铅蓄电池在充电时,原来负极发生的反应是:Pb+SO42―–2e―=PbSO4
PbO2放电时是电池的负极,充电时是电池的阳极。 负极的电极反应式为:Pb + SO – 2e – = PbSO4 放电时,PbO2得电子,被氧化 电池放电时,溶液酸性增强
– 2e – = PbSO4 放电时,PbO2得电子,被氧化 电池放电时,溶液酸性增强
放电时,负极质量增加  充电时,应将外接直流电源的正极与蓄电池的铅电极相接 放电时,正极反应为: 铅蓄电池做电源电解Na2SO4溶液时,当有lmolO2产生时,消耗4molH2SO4
充电时,应将外接直流电源的正极与蓄电池的铅电极相接 放电时,正极反应为: 铅蓄电池做电源电解Na2SO4溶液时,当有lmolO2产生时,消耗4molH2SO4
PbO2是电源的负极 负极的电极反应式为:Pb+SO42- -2e- =PbSO4 电池放电时,溶液的pH增大 电池放电时,PbO2得电子,被氧化
铅蓄电池A.极应与U.形管中a极连接 铅蓄电池放电时溶液的pH值变小 a电极用铁作电极,b电极用石墨作电极 实验结束后可将U.型管、试管中的溶液倒入下水道
PbO2是电池的负极 负极的电极反应式为:Pb(s)+SO42(aq)–2e – = PbSO4(s) 铅蓄电池属于一次电池 电池放电时,溶液酸性增强
PbO2是电池的负极 负极的电极反应式为:Pb + SO42- 2e == PbSO4 PbO2得电子,被氧化 电池放电时,溶液酸性增强
PbO2是电池的负极 负极的电极反应式为:Pb + SO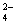 - 2e—
- 2e—  PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强
PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强
PbO2是电池的负极 负极的电极反应式为:Pb(s)+SO42-(aq)–2e – = PbSO4(s) 铅蓄电池属于一次性电池 电池放电时,溶液酸性增强
放电时正极PbO2和负极Pb均生成PbSO4,并且电解液相对密度变小; 充电时PbSO4正极转变为PbO2,负极转变为Pb,并且电解液相对密度变小; 充电时PbSO4正极转变为Pb,负极转变为PbO2,并且电解液相对密度变小 放电时负极PbO2和正极Pb均生成PbSO4,并且电解液相对密度变小;
PbO2是电池的负极 放电时,溶液中的H+ 向正极区移动 ,正极区域的溶液的酸性增强 放电时,电子由Pb 极通过导线流向 PbO2 正极的电极反应式为Pb-2e-=Pb2+
PbO2是电池的负极 负极的电极反应式为:Pb+SO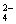 –2e–=PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强
–2e–=PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强
放电时负极电极反应式:PbO2 +4H++SO42- +2e- = PbSO4+2H2O 放电时,正负电极的质量均减少 转移2mol电子时,消耗硫酸2mol 若要使1mol PbO2转化,则经过溶液的电子数为2mol
铅蓄电池A.极应与U.形管中a极连接 铅蓄电池放电时溶液的pH值变小 a电极用铁作电极,b电极用石墨作电极 实验结束后可将U.型管、试管中的溶液倒入下水道
放电时Pb为负极 充电时阳极的电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42- 放电完全后铅蓄电池可进行充电,此时铅蓄电池的负极连接外电源的正极 用铅蓄电池电解CuCl2溶液,若制得2.24L Cl2(标准状况),这时电池内至少转移 0.2 mol电子
PbO2是电池的负极 负极的电极反应式为:Pb + SO42-- 2e - = PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强
PbO2是电池的负极 负极的电极反应式为:Pb(s)+SO42-(aq)–2e – = PbSO4(s) 铅蓄电池属于一次电池 电池放电时,溶液酸性增强
Pb02是电池的负极 负极的电极反应式为:Pb+SO42--2e-=PbSO4 PbO2得电子,被氧化 电池放电时,溶液酸性增强

 – 2e – = PbSO4 放电时,PbO2得电子,被氧化 电池放电时,溶液酸性增强
– 2e – = PbSO4 放电时,PbO2得电子,被氧化 电池放电时,溶液酸性增强
 充电时,应将外接直流电源的正极与蓄电池的铅电极相接 放电时,正极反应为: 铅蓄电池做电源电解Na2SO4溶液时,当有lmolO2产生时,消耗4molH2SO4
充电时,应将外接直流电源的正极与蓄电池的铅电极相接 放电时,正极反应为: 铅蓄电池做电源电解Na2SO4溶液时,当有lmolO2产生时,消耗4molH2SO4
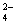 - 2e—
- 2e—  PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强
PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强
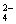 –2e–=PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强
–2e–=PbSO4↓ PbO2得电子,被氧化 电池放电时,溶液酸性增强