你可能感兴趣的试题
减小、增大、减小 增大、减小、减小 减小、增大、增大 增大、减小、增大
溶液的pH减小 CH3COOH的电离程度增大 溶液的导电能力减小 溶液的c(OH-) 增大
溶液中由水电离产生的H.+浓度为1×10-7 mol/L c(CH3COO-)+c(CH3COOH)-c(Na+)=0.05 mol/L 溶液中CH3COOH的电离程度小于CH3COONa的水解程度 溶液中离子浓度的大小关系为:c(Na+)>c(CH3COO-)>c(H.+)>c(OH-)
减小、增大、减小 增大、减小、减小 减小、增大、增大 增大、减小、增大
室温下,将pH=2的醋酸与pH=12的NaOH溶液等体积混合,溶液显中性 室温下,向pH=3的醋酸溶液加水稀释后,溶液中所有离子浓度均减小 向含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 向CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-)
溶液的pH增大 CH3COOH电离程度增大 溶液的导电能力减弱 溶液中c(OH-) 减小
溶液的pH增大 CH3COOH的电离程度增大 溶液的导电能力减小 溶液中n(H+)减小
加入少量NaOH固体后溶液pH小于9
加水稀释,CH3COONa水解程度增大,c(OH-)增大 该溶液水电离出的c(OH-)== 10-5 mol/L 通入一定体积的HCl气体,CH3COONa水解程度增大,溶液碱性增强。
加入适量纯CH3COOH 加入少量NaCl固体 加水稀释 加入少量NaOH固体
加入少量NaOH固体,c(CH3COO-)减小 升高温度,溶液的pH增大 稀释溶液,溶液的pH增大 通入少量HCl气体,水解平衡常数减小
溶液的pH增大 CH3COOH的电离程度增大 溶液的导电能力减小 溶液的c (OH – )减小
升高温度,平衡正向移动,醋酸的电离常数Ka增大 0.10 mol/L.的CH3COOH 溶液加水稀释,溶液中c(OH-)增大 CH3COOH.溶液加少量的CH3COONa固体,平衡逆向移动 室温下,欲使0.1 mol/L.醋酸溶液的pH、电离度α都减小,可加入少量水
以上实验数据都可以说明CH3COONa溶液中存在水解平衡 CH3COONa水解平衡常数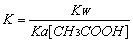 在室温将0.1mol/L CH3COONa溶液加水稀释到0.01mol/L,pH由8.75变化到8.27,可以说明0.1mol/LCH3COONa溶液水解程度更大 加热0.1mol/L的CH3COONa溶液,pH的变化可说明温度升高,K.增大
在室温将0.1mol/L CH3COONa溶液加水稀释到0.01mol/L,pH由8.75变化到8.27,可以说明0.1mol/LCH3COONa溶液水解程度更大 加热0.1mol/L的CH3COONa溶液,pH的变化可说明温度升高,K.增大
溶液的pH增大 CH3COOH的电离程度增大 溶液的导电能力减小 溶液的c (OH – )减小
溶液中由水电离产生的H.+浓度小于1×10-7 mol/L 溶液中CH3COOH的电离程度大于CH3COONa的水解程度 c(CH3COO¯ ) + c(CH3COOH)-c(Na+) = 0.1 mol/L 溶液中离子浓度的大小关系为:c(CH3COO¯)>c(Na+)>c(H+)>c(OH¯)

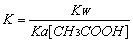 在室温将0.1mol/L CH3COONa溶液加水稀释到0.01mol/L,pH由8.75变化到8.27,可以说明0.1mol/LCH3COONa溶液水解程度更大 加热0.1mol/L的CH3COONa溶液,pH的变化可说明温度升高,K.增大
在室温将0.1mol/L CH3COONa溶液加水稀释到0.01mol/L,pH由8.75变化到8.27,可以说明0.1mol/LCH3COONa溶液水解程度更大 加热0.1mol/L的CH3COONa溶液,pH的变化可说明温度升高,K.增大