你可能感兴趣的试题
Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(K.+) Va=Vb时:c(CH3COOH)+c(H.+)=c(OH-) Vac(K.+)>c(OH-)>c(H.+) Va与Vb任意比时:c(K.+)+c(H.+)=c(OH-)+c(CH3COO-)
溶液中由水电离产生的H.+浓度为1×10-7 mol/L c(CH3COO-)+c(CH3COOH)-c(Na+)=0.05 mol/L 溶液中CH3COOH的电离程度小于CH3COONa的水解程度 溶液中离子浓度的大小关系为:c(Na+)>c(CH3COO-)>c(H.+)>c(OH-)
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H.+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大 25℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O
CH3COO-+H.+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大 25℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O H++OH-逆向移动,c(H+)降低 取c(H+)=0.01 mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO3-)
H++OH-逆向移动,c(H+)降低 取c(H+)=0.01 mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO3-)
CH3COOH溶液中离子浓度的关系满足:[H+]=[OH-]+[CH3COO-] 0.1 mol·L-1的CH3COOH溶液加水稀释,溶液中[OH-]增大 CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动 常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
室温下,将pH=2的醋酸与pH=12的NaOH溶液等体积混合,溶液显中性 室温下,向pH=3的醋酸溶液加水稀释后,溶液中所有离子浓度均减小 向含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 向CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-)
溶液的pH增大 CH3COOH电离程度增大 溶液的导电能力减弱 溶液中c(OH-) 减小
同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 含1molKOH的溶液与1molCO2完全反应后,溶液中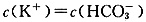 在CH3COONa溶液中力口入适量CH3COOH,可使c(Na+)=c(CH3COO-)
在CH3COONa溶液中力口入适量CH3COOH,可使c(Na+)=c(CH3COO-)
pH=2的HA溶液与pH=12的MOH溶液任意比混合: c(H+) + c(M+) === c(OH-) + c(A-) pH相等的CH3COONa、NaOH和Na2CO3三种溶液: c(NaOH)<c(CH3CO ONa)<c(Na2CO3) 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合: c(CH3COO-) +2c(OH-) === c(H+) + c(CH3COOH) 0.1mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
升高温度,平衡正向移动,醋酸的电离常数Ka增大 0.10 mol/L.的CH3COOH 溶液加水稀释,溶液中c(OH-)增大 CH3COOH.溶液加少量的CH3COONa固体,平衡逆向移动 室温下,欲使0.1 mol/L.醋酸溶液的pH、电离度α都减小,可加入少量水
c(H+)c(CH3COOH)+c(CH3COO-)=0.2mol/L c(CH3COOH) >c(CH3COO-) c(CH3COO-)+ c(OH-)=0. 1mol/L
加入少量NaOH固体,平衡向正反应方向移动 加水,反应速率增大,平衡向逆反应方向移动 滴加少量0.1mol/LHCl溶液,溶液中C.(H+)减少 加入少量CH3COONa固体,平衡向正反应方向移动
浓度均为0.1 mol·L-1的NaF、CH3COONa溶液相比较,CH3COONa溶液碱性较强 0.1 mol·L-1 CH3COOH溶液,加水稀释过程中,所有离子浓度均减小 NaF溶液中只含有Na+、F.-、H.+、OH-、H2O五种微粒 NaF溶液中加入少量NaOH固体,溶液中c(F-)变小
加入水时,溶液中c(H+) 和c(OH—) 都减小 加入少量NaOH固体,平衡向正反应方向移动 加入少量0.1mol/L HCl溶液,溶液中c(H+)减小 加入少量CH3COONa固体,平衡向正反应方向移动
c(H+)+c(CH3COO-)+c(CH3COOH)=0.1mol/L 加入少量0.1mol/L的盐酸,电离平衡向左移动,c(H+)减小 加入少量NaOH固体,电离平衡向右移动,溶液导电性增强 加入少量CH3COONa固体,电离平衡向左移动,溶液导电性减弱
溶液中由水电离产生的H.+浓度小于1×10-7 mol/L 溶液中CH3COOH的电离程度大于CH3COONa的水解程度 c(CH3COO¯ ) + c(CH3COOH)-c(Na+) = 0.1 mol/L 溶液中离子浓度的大小关系为:c(CH3COO¯)>c(Na+)>c(H+)>c(OH¯)

 CH3COO-+H.+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大 25℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O
CH3COO-+H.+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大 25℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O H++OH-逆向移动,c(H+)降低 取c(H+)=0.01 mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO3-)
H++OH-逆向移动,c(H+)降低 取c(H+)=0.01 mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO3-)
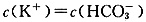 在CH3COONa溶液中力口入适量CH3COOH,可使c(Na+)=c(CH3COO-)
在CH3COONa溶液中力口入适量CH3COOH,可使c(Na+)=c(CH3COO-)