你可能感兴趣的试题
pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R2-)+c(HR-)=c(Na+) 若0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合后,溶液的pH = 9,则: c(OH-)-c(HY)=c(H+)=1×10-9mol/L 0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH=1 NaHCO3溶液中:c(H+) + c(H2CO3)=c(CO32-) + c(OH-)
100℃纯水的pH=6,说明加热可导致水呈酸性 pH=4的醋酸溶液,稀释至10倍后pH=5 0.2 mol/L的盐酸与等体积水混合后pH=1(混合后溶液体积变化忽略不计) 将pH=5的硫酸溶液稀释500倍后所得溶液中c(H+):c(SO42-)=2:1
若混合后所得溶液呈中性,则HA肯定是强酸、BOH肯定是强碱 若混合前酸、碱物质的量浓度相同,混合后所得溶液呈酸性,则HA肯定是弱酸 若混合前酸、碱pH之和等于14,混合后所得溶液呈碱性,则BOH肯定是弱碱 若混合后所得溶液呈酸性,则混合溶液中离子浓度一定满足: 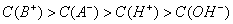
在①、②中分别加入氯化铵晶体,两溶液的pH值均增大 分别将等体积的①和②加水稀释120倍,所得溶液的pH:①>② 把①、④两溶液等体积混合后所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) 将溶液②和溶液③等体积混合,混合后所得溶液pH=7
混合后溶液pH=7 所得混合溶液中 所得混合溶液中存在
所得混合溶液中存在 混合后溶液中存在
混合后溶液中存在
等物质的量浓度的Na2CO3和NaHCO3混合液中: c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(OH﹣)>c(H.+) 25℃时 0.2 mol•L﹣1盐酸与等体积0.05 mol.L.﹣1Ba(OH)2溶液混合后,溶液的pH=l 25℃时,pH=3的二元弱酸H.2R.溶液与pH=ll的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R.2﹣)+c(HR﹣)=c(Na+) 25℃时,若0.3 mol.L.﹣1 HY溶液与0.3 mol.L.﹣lNaOH溶液等体积混合后,溶液的pH=9,则:c(OH﹣)﹣c(HY)=1×lO﹣9 mol.L.﹣1
3.0-3.3 3.3-3.5 3.5-4.0 3.7-4.3
0.2 mol·L-1的盐酸与等体积水混合后pH=1 pH=3的醋酸溶液,稀释至10倍后pH=4 95 ℃纯水的pH<7,说明加热可导致水呈酸性 pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7
3.0~3.3 3.3~3.5 3.5~4.0 3.7~4.3
H+浓度增大10倍,pH值也增大10倍 把两个pH值分别为1、2的强酸溶液按等体积混合后,所得溶液pH值为1.5 把pH=1的酸溶液与pH=13的碱溶液等体积混合后,所得溶液pH值为7 把pH=1的酸溶液与pH=14的碱溶液等体积混合后,所得溶液pH值为7
若a=b且c(X-)>c(Y-),则酸性HX>HY 若a>b且c(X-) = c(Y-),则酸性HX>HY 若a若向HX溶液加入等浓度等体积NaOH溶液,所得溶液pH>7,则HX为弱酸
在①、②中分别加入氯化铵晶体,两溶液的pH值均增大 分别将等体积的①和②加水稀释100倍,所得溶液的pH:①>② 把①、④两溶液等体积混合后所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) 将溶液②和溶液③等体积混合,混合后所得溶液pH=7

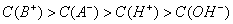
 所得混合溶液中存在
所得混合溶液中存在 混合后溶液中存在
混合后溶液中存在