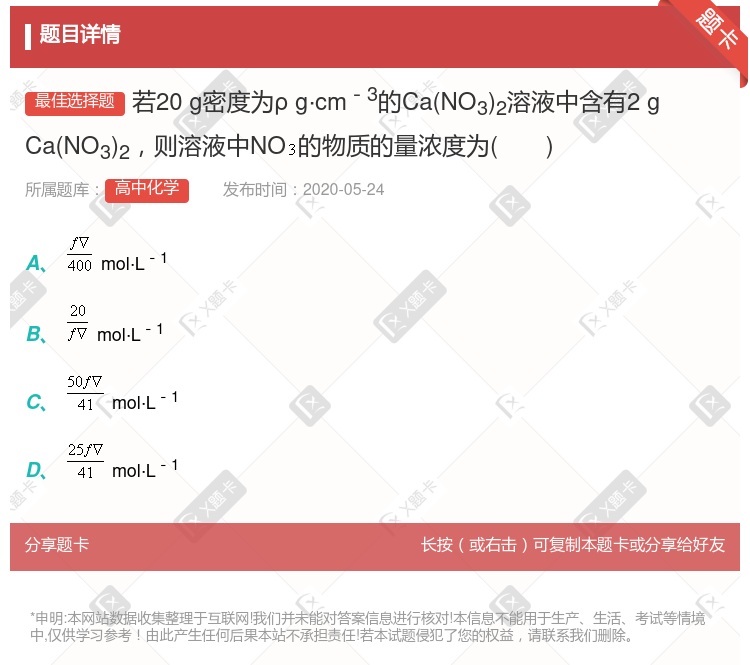
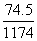 ×100% 20℃时,密度小于1.174 g/cm3的KCl溶液也可能是饱和溶液 将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174 g/cm3
×100% 20℃时,密度小于1.174 g/cm3的KCl溶液也可能是饱和溶液 将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174 g/cm3
 20℃时,密度小于1.174g·cm-3的KCl溶液是不饱和溶液 将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174g·cm-3
20℃时,密度小于1.174g·cm-3的KCl溶液是不饱和溶液 将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174g·cm-3
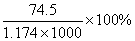 密度大于1.174 g·cm-3的KCl溶液是过饱和溶液 25℃时,饱和KCl溶液的浓度大于4.0 mol·L-1
密度大于1.174 g·cm-3的KCl溶液是过饱和溶液 25℃时,饱和KCl溶液的浓度大于4.0 mol·L-1
 ×100% 25 ℃时,饱和KCl溶液的浓度小于4.0 mol·L-1 将此溶液蒸发部分水,再恢复到20 ℃时,溶液密度一定大于1.174 g·cm-3
×100% 25 ℃时,饱和KCl溶液的浓度小于4.0 mol·L-1 将此溶液蒸发部分水,再恢复到20 ℃时,溶液密度一定大于1.174 g·cm-3
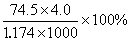 25℃时,密度小于1.174g/cm3的KCl溶液是不饱和溶液 将此溶液蒸发部分水,再恢复到20℃时, 溶液密度大于1.174g/cm3
25℃时,密度小于1.174g/cm3的KCl溶液是不饱和溶液 将此溶液蒸发部分水,再恢复到20℃时, 溶液密度大于1.174g/cm3

 g·cm-3
g·cm-3  g·cm-3
g·cm-3  g·cm-3
g·cm-3  g·cm-3
g·cm-3
 mol·L-1 2.5ρ mol·L-1 1.25ρ mol·L-1
mol·L-1 2.5ρ mol·L-1 1.25ρ mol·L-1
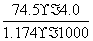 ×100% 20℃,密度小于1.174 g·cm-3的KCl溶液是不饱和溶液 将此溶液蒸发部分水再恢复到20℃时,溶液密度一定大于1.174 g·cm-3
×100% 20℃,密度小于1.174 g·cm-3的KCl溶液是不饱和溶液 将此溶液蒸发部分水再恢复到20℃时,溶液密度一定大于1.174 g·cm-3
 20℃时,密度小于1.174 g·cm-3的KCl溶液是不饱和溶液 将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174 g·cm-3
20℃时,密度小于1.174 g·cm-3的KCl溶液是不饱和溶液 将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174 g·cm-3