你可能感兴趣的试题
溶液中一定有1 mol Na2SO4和3 mol NaCl
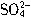 所带电荷数是Na+所带电荷数的3/5倍
所带电荷数是Na+所带电荷数的3/5倍
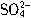 与Cl-的物质的量之和等于Na+的物质的量
与Cl-的物质的量之和等于Na+的物质的量
Na2SO4和NaCl的物质的量浓度之比为1∶3
等物质的量浓度的NaCl和AlCl3混合液完全电解后,所得的混合液的pH值增大 NaCl溶液电解一定时间后,要恢复到电解前状态,应加入适量盐酸 Na2SO4溶液在电解过程中,阴极区pH值降低 电解CuSO4溶液,阳极反应式为:2H2O+O2+4e-=4OH-
NaOH、Na2SO4、NaCl NaCl、NaOH、Na2SO4 NaCl、Na2SO4、NaOH Na2SO4、NaCl、NaOH
Ba(NO3)2、HCl BaCl2、NaCl NH4Cl、CaCl2 MgCl2、(NH4)2SO4
1 mol 0.5 mol 0.25 mol 0.15 mol
Na2SO4 和NaCl的物质的量之比为1 :3 溶液中一定有1molNa2SO4和3molNaCl 所带电荷数SO42-是Na+的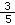 倍 SO42- 与Cl-的物质的量之和等于Na+的物质的量
倍 SO42- 与Cl-的物质的量之和等于Na+的物质的量
将溶液蒸干最多可以得到4 mol NaCl 将溶液蒸干并灼烧,得到的固体可能是NaCl、NaBr、Na2SO4 向溶液中滴加KI淀粉溶液,溶液变蓝,则氯气一定过量 若通入氯气的体积为11.2L.(标准状况),反应的离子方程式为:2I-+Cl2=I2+2C1-
1 mol 0.5 mol 0.25 mol 0.15 mol
K2SO4、BaCl2、NaNO3、NaCl HCl、(NH4)2SO4、Ba(OH)2、Na2SO4 KOH、Na2SO4、CuSO4、MgCl2 KCl、AgNO3、KNO3、NaCl
中逐滴加入Na2SO4和NaOH的混合液 ,产生沉淀的物质的量和加入溶液B.的体积关系如图所示:则Na2SO4与FeCl3的物质的量浓度之比为 ( )  A.1:1B.10:1 2:1 5:1
A.1:1B.10:1 2:1 5:1
NaCl、Na2SO4 NaCl、NaBr、Na2SO4 NaCl、Na2SO4、I2 NaCl、NaI、Na2SO4
NaCl Na2SO4 NaBr Na2SO4 NaCl Na2SO4 I2 NaCl NaI Na2SO4

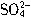 所带电荷数是Na+所带电荷数的3/5倍
所带电荷数是Na+所带电荷数的3/5倍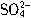 与Cl-的物质的量之和等于Na+的物质的量
与Cl-的物质的量之和等于Na+的物质的量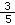 倍 SO42- 与Cl-的物质的量之和等于Na+的物质的量
倍 SO42- 与Cl-的物质的量之和等于Na+的物质的量
 A.1:1B.10:1 2:1 5:1
A.1:1B.10:1 2:1 5:1