你可能感兴趣的试题
该温度下醋酸的电离平衡常数约为1×10-5mol·L-1 图中V1 > 20mL,且a点对应的溶液中:c (Na+)+ c (H+) = c (OH-)+ c (CH3COO-) 图中V1 < 20mL,且a点对应的溶液中:c (CH3COOH) + c (CH3COO-) +) 当加入Na OH溶液的体积为20mL时,溶液中:c (CH3COOH) + c (H+) > c (OH-)
将0.2 mol·L-1盐酸与0.2 mol·L-1K2CO3溶液等体积混合: c(K+) >c(Cl-) >c(HCO3-) >c(OH-) >c(H+) 25℃时,pH=10、浓度均为0.1 mol·L-1的HCN与NaCN的混合溶液中: c(Na+)>c(CN-)>c(HCN)>c(OH-) 0.3 mol·L-1HY溶液与0.3 mol·L-1NaOH溶液等体积混合后,溶液的pH=9,则:c(OH-)-c(HY)=c(H+)=1×10-9 mol·L-1 用0.1 mol·L-1HCl溶液滴定10.0 mL浓度为0.1 mol·L-1NaCO3溶液,当混合液呈中性时,c(Na+)> c(Cl-) > c(H+)= c(OH-)
灯光明暗程度不变
灯光变暗
灯光明暗程度变化不大
灯光变亮
Ⅱ表示的是滴定盐酸的曲线 PH=7时,滴定醋酸消耗V(NaOH)小于20ml V(NaOH) =20ml时,c(Cl-)=c(CH3COO-) V(NaOH) =10ml时,醋酸溶液中: c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
Ⅱ表示的是滴定醋酸的曲线 pH=7时,滴定醋酸消耗的V(NaOH)小于20mL V(NaOH)=20.00 mL 时,两份溶液中c(Cl-)=c(CH3COO-) V(NaOH)=10.00mL 时,醋酸溶液中c(Na+)>c(CH3COO-)> c(OH-)> c(H+)
298K时,HCOOH的电离常数Ka=1.0×10-10.25 0.1mol·L-1HCONa溶液中有c(HCOO-)+c(HCOOH)+C(OH-)<(H+)+0.1 298K时,加蒸馏水稀释P.点溶液,溶液中n(H+)·n(OH-)增大 0.1mol·L-1HCOCNa溶液和0.1mol·L-1HCOOH溶液等体积混合后,溶液的pH=3.75(混合后溶液体积变化忽略不计)
Ⅰ表示的是滴定盐酸的曲线 PH=7时,滴定醋酸消耗V.(NaOH)小于20mL V.(NaOH) =20mL时,两份溶液中c(Cl—)=c(CH3COO—) V.(NaOH) =10mL时,醋酸溶液中: c(Na+ )> c(CH3COO—)>c(H+ )> c(OH—)
将40 g NaOH溶于1L. 水所得的溶液 将0.5 mol·L-1的NaNO3溶液100 mL 加热蒸发掉50 g水所得的溶液 将23 g Na 溶于1L.水并配成溶液 含K.+为2 mol·L-1的K2SO4溶液
MOH是强电解质 b点对应的盐不水解 水的离子积Kw:b>c>a c点溶液中c(CH3COO-)>c(M+)>c(H+)>c(OH-)
150ml 1mol·L-1 NaCl溶液 75ml 2mol·L-1 KClO3溶液 150ml 2mol·L-1 KCl溶液 75ml 1mol·L-1 FeCl3溶液
左图是滴定盐酸的曲线 E.点时溶液中离子浓度为c(Na+) = c(A.—) B.点时,反应消耗溶液体积:V.(NaOH)>V.(HA) 当0mL<V.(NaOH)<20. 00mL时,溶液中一定是c(A.-)>c(Na+)>c(H+) >c(OH-)
大于20 mL 小于20 mL 等于20 mL 等于5 mL
298K 时,0.1mol·L-1HX 溶液中HX的电离度为1% V=10mL时,同时微热溶液(忽略体积变化), 逐渐增大 V=20mL 时,HX曲线对应的溶液中c(Na+)=c(X-)>c(H+)=c(OH-) 滴定这两种溶液时都可以选择甲基橙替代酚酞作指示剂
逐渐增大 V=20mL 时,HX曲线对应的溶液中c(Na+)=c(X-)>c(H+)=c(OH-) 滴定这两种溶液时都可以选择甲基橙替代酚酞作指示剂
50mL 0.2mol·L-1的 NaCl 溶液 100mL 0.1mol·L-1的 NaCl 溶液 25mL 0.2mol·L-1的 Na2SO4 溶液 10mL 0.5mol·L-1的 Na2CO3 溶液
该滴定过程应该选择酚酞作为指示剂 M点对应的盐酸体积为20.0mL M点处的溶液中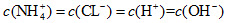 N点处的溶液中pH<12
N点处的溶液中pH<12
20℃时 5mL 0.05mol·L-1 Na2S2O3溶液与5mL 0.1mol·L-1硫酸混合 20℃时 50mL 0.1mol·L-1 Na2S2O3溶液与50mL 0.1mol·L-1硫酸混合 10℃时 5mL 0.05mol·L-1 Na2S2O3溶液与5mL 0.1mol·L-1硫酸混合 10℃时 5mL 0.1mol·L-1 Na2S2O3溶液与5mL 0.1mol·L-1硫酸混合
Ⅱ表示的是滴定醋酸的曲线 PH=7时,滴定醋酸消耗V.(NaOH)小于20mL V.(NaOH)=20mL时,c(Cl﹣)=c(CH3COO﹣) V.(NaOH)=10mL时,醋酸溶液中:c(Na+)>c(CH3COO﹣ )>c(H+)>c(OH﹣ )


 逐渐增大 V=20mL 时,HX曲线对应的溶液中c(Na+)=c(X-)>c(H+)=c(OH-) 滴定这两种溶液时都可以选择甲基橙替代酚酞作指示剂
逐渐增大 V=20mL 时,HX曲线对应的溶液中c(Na+)=c(X-)>c(H+)=c(OH-) 滴定这两种溶液时都可以选择甲基橙替代酚酞作指示剂
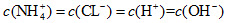 N点处的溶液中pH<12
N点处的溶液中pH<12