你可能感兴趣的试题
摩尔是化学上常用的一个物理量 用托盘天平称取25.20 gNaCl 配制一定物质的量浓度的溶液,定容时俯视刻度线会导致所配溶液浓度偏小 某物质含有6.02×1023个微粒,含有这个数目微粒的物质不一定是1 mol
pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(OH-)相等 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH) 常温下物质的量浓度相等的①NH4HCO3、②NH4HSO4、③NH4Fe(SO4)2:三种溶液中NH4+的浓度:②>③>① 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N.前>N后
物质的量浓度相等的 和
和 混合溶液中:
混合溶液中:  常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:
常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:  常温下
常温下 相等的①
相等的① 、②
、② 、③
、③ 三种溶液中,溶质的物质的量浓度大小:①>②>③ 等体积、等物质的量浓度的
三种溶液中,溶质的物质的量浓度大小:①>②>③ 等体积、等物质的量浓度的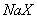 和弱酸
和弱酸 混合后呈酸性的溶液中:
混合后呈酸性的溶液中: 
溶液的上层浓度小,下层浓度大 溶液蒸干后,均能得到固体溶质 溶液中只有一种溶质时,溶液为纯净物 物质在溶解得到溶液的过程中,通常有放热或吸热的现象出现
配制一定物质的量浓度的溶液时,定容时仰视刻度线会导致所配溶液浓度偏高
用托盘天平称取25.20g NaCl
用100mL量筒量取5.2mL盐酸
用浓盐酸配制一定物质的量浓度的稀盐酸,量取浓盐酸时仰视量筒的刻度线会导致所配溶液浓度偏高
溶液的pH:a<b<c<d 溶液的导电能力:a>b>d>c a、b溶液呈酸性 c、d溶液呈碱性
等体积等物质的量浓度NaF 溶液与HF混合:2c(Na+)=c(F)+c(HF) 0.1mol・L-1pH为4的NaHB溶液中:c(HB-)>c(H2B.)>c(B2-) 在NaHA溶液中一定有:c(Na+)+c(H+) =c(HA)+c(OH)+c(A2-) 等物质的量浓度的 (NH4)2SO4 和(NH4)2CO3溶液中的c(NH4+):前者<后者
酸性:HCN>HClO pH:HClO<HCN 浓度:c(CN-)<c(ClO-) 与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN
常温下, 10 mL 0.2 mol/L NH4NO3溶液与10 mL 0.1mol/L NaOH溶液混合后所得pH=9.6的溶液中:c(NO3-)>c(Na+)>c(NH3·H2O)>c(OH-)>c(H+) 溶液X.:10 mL 0.1mol/L NaCl;溶液Y.:10mL 0.1mol/L CH3COONa。 X.中离子总浓度<Y.中离子总浓度 0.1 mol/LNa2S溶液中:c(Na+)>c(S2-)>c(HS-)>c(OH-)>c(H+) 常温下amL 0.1mol/L KOH与bmL 0.1mol/LHCN两溶液混合后pH>7,则一定有a≥b
Mg和Al的总质量为8 g 硫酸的物质的量浓度为5 mol・L─1 NaOH溶液的物质的量浓度为5 mol・L─1 生成的H2在标准状况下的体积为11.2L.
溶液的pH:a溶液的导电能力:a>b>d>c a、b溶液呈酸性 c、d溶液呈碱性
配制一定物质的量浓度的溶液时,定容时仰视刻度线会导致所配溶液浓度偏高 用托盘天平称取25.20 g NaCl 用100 mL的量筒量取5.2 mL的盐酸 用浓盐酸配制一定物质的量浓度的稀盐酸,量取浓盐酸时仰视量筒的刻度线会导致所配溶液浓度偏高
溶液的上层浓度小,下层浓度大 溶液蒸干后,均能得到固体溶质 溶液中只有一种溶质时,溶液为纯净物 物质在溶解得到溶液的过程中,通常有放热或吸热的现象出现
向0.1 mol·L-1NH4Cl溶液中通入一定量氨气:c(Cl-)>c(NH4+)>c(OH-)>c(H+) 将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)>c(Cl-) 已知Ka(HF)=7.2×10-4,Ka(HCN)=6.2×10-10,等体积等浓度的NaF、NaCN溶液中,前者离子总数小于后者 浓度均为0.1 mol·L-1的①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2溶液中, c(NH )的大小顺序为:③>②>①
)的大小顺序为:③>②>①
硫酸溶液的体积为20 mL b时刻溶液中SO42-的浓度约为0.125 mol·L-1
.d时刻溶液的pH约为13 溶液的导电能力:c
溶液的pH:a<b<c<d 溶液的导电能力:a>b>d>c a、b溶液呈酸性 c、d溶液呈碱性
NaHSO3和NaHCO3的中性混合溶液中(S.和C.均用R.表示):c(Na+)=c(HRO3-)+2c(RO32-) 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl―)>c(CH3COOH) 常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<③<② 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N.前后
配制1L. 0.1 mol/L的NaCl溶液时用托盘天平称量5.85 g NaCl固体 配制一定物质的量浓度的NaOH溶液时,定容时仰视刻度线导致浓度偏低 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,立即转移到容量瓶中 容量瓶用蒸馏水洗净后,必须干燥方能用于配制溶液
物质的量就是指物质的多少 原子、电子、中子、 桌子等都可用物质的量来描述 物质的量是用来描述微观粒子的基本单位之一 物质的量是以摩尔为单位计量微粒数目的物理量

 和
和 混合溶液中:
混合溶液中:  常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:
常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:  常温下
常温下 相等的①
相等的① 、②
、② 、③
、③ 三种溶液中,溶质的物质的量浓度大小:①>②>③ 等体积、等物质的量浓度的
三种溶液中,溶质的物质的量浓度大小:①>②>③ 等体积、等物质的量浓度的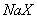 和弱酸
和弱酸 混合后呈酸性的溶液中:
混合后呈酸性的溶液中: 

 )的大小顺序为:③>②>①
)的大小顺序为:③>②>①