你可能感兴趣的试题
铜的金属活泼性比铁的弱,可在海轮外壳上镶入若干铜块以减缓其腐蚀 向0.1 mol·L-1 CH3COONa溶液中加入少量水,溶液中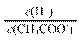 减小 一定温度下,增大反应2BaO2(s)
减小 一定温度下,增大反应2BaO2(s) 2BaO(s)+O2(g)容器的体积,平衡不移动 反应TiO2(s) + 2Cl2(g)=TiCl4(g) + O2(g) ΔH.>0能自发进行,其原因是ΔS>0
2BaO(s)+O2(g)容器的体积,平衡不移动 反应TiO2(s) + 2Cl2(g)=TiCl4(g) + O2(g) ΔH.>0能自发进行,其原因是ΔS>0
3∶2∶1∶4 1∶1∶1∶1 2∶1∶2∶2 1∶2∶1∶1
平衡常数减小 BaO量不变 氧气压强不变 BaO2量减小
BaO2和Na2O2都能跟水反应放出O2
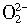 的电子式为
的电子式为
BaO2在水中以Ba2+和 形式存在
形式存在
BaO2的熔点可能低于100℃
等质量的乙烯和丙烯中,所含碳原子数之比为2∶3 等体积、等浓度的NH4Cl溶液和稀氨水中,所含NH4+的数目相等 等物质的量的过氧化钡(BaO2)和Ba(OH)2固体中,阴阳离子个数比均为2∶1 等物质的量的Cl2分别与足量的Fe和Cu反应,转移的电子数相等
平衡常数减小 BaO量不变 氧气压强不变 BaO2量增加
密闭容器中氨气的浓度不变 密闭容器中总压强不变 密闭容器中混合气体的密度不变 2v(NH3)=v(CO2)
保持体积和温度不变,充入一定量的氧气 保持温度不变,缩小容器的体积 保持体积不变,升高温度 保持体积和温度不变,加入BaO2
绝热恒容密闭容器中通入A.和 ,发生反应:2A (g)+B (g)  2C(g),图甲为其正反应速率随时间变化的示意图,则该反应为放热反应。 B.催化剂能降低反应的活化能,提高活化分子的百分含量,从而加快化学反应速率。图乙显示的是催化反应与无催化反应过程中的能量关系。 将BaO2放入密闭真空容器中,反应2BaO2(s)
2C(g),图甲为其正反应速率随时间变化的示意图,则该反应为放热反应。 B.催化剂能降低反应的活化能,提高活化分子的百分含量,从而加快化学反应速率。图乙显示的是催化反应与无催化反应过程中的能量关系。 将BaO2放入密闭真空容器中,反应2BaO2(s)  2BaO(s)+O2(g)达到平衡时体系压强为P.,保持温度不变,t0时刻将容器体积缩小为原来的1/2,体系重新达到平衡,体系压强变化如图丙所示。 将一定量的NO2充入针筒中后封口,发生反应2NO2 (g)
2BaO(s)+O2(g)达到平衡时体系压强为P.,保持温度不变,t0时刻将容器体积缩小为原来的1/2,体系重新达到平衡,体系压强变化如图丙所示。 将一定量的NO2充入针筒中后封口,发生反应2NO2 (g)  N2O4(g),图丁表示在拉伸和压缩针筒活塞的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。则c点与a点相比,c(NO2)增大,c(N2O4)减小。
N2O4(g),图丁表示在拉伸和压缩针筒活塞的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。则c点与a点相比,c(NO2)增大,c(N2O4)减小。
平衡常数减小 BaO量不变 氧气压强不变 BaO2量增加
平衡常数减小 BaO量不变 氧气压强不变 BaO2量不增加
图1表示1 L pH=2的CH3COOH溶液加水稀释至V.L.,pH随lg V.的变化 图2表示不同温度下水溶液中H.+和OH-浓度的变化的曲线,图中温度T.2>T.1 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)  2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系

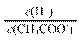 减小 一定温度下,增大反应2BaO2(s)
减小 一定温度下,增大反应2BaO2(s) 2BaO(s)+O2(g)容器的体积,平衡不移动 反应TiO2(s) + 2Cl2(g)=TiCl4(g) + O2(g) ΔH.>0能自发进行,其原因是ΔS>0
2BaO(s)+O2(g)容器的体积,平衡不移动 反应TiO2(s) + 2Cl2(g)=TiCl4(g) + O2(g) ΔH.>0能自发进行,其原因是ΔS>0
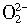 的电子式为
的电子式为
 形式存在
形式存在 2C(g),图甲为其正反应速率随时间变化的示意图,则该反应为放热反应。 B.催化剂能降低反应的活化能,提高活化分子的百分含量,从而加快化学反应速率。图乙显示的是催化反应与无催化反应过程中的能量关系。 将BaO2放入密闭真空容器中,反应2BaO2(s)
2C(g),图甲为其正反应速率随时间变化的示意图,则该反应为放热反应。 B.催化剂能降低反应的活化能,提高活化分子的百分含量,从而加快化学反应速率。图乙显示的是催化反应与无催化反应过程中的能量关系。 将BaO2放入密闭真空容器中,反应2BaO2(s)  2BaO(s)+O2(g)达到平衡时体系压强为P.,保持温度不变,t0时刻将容器体积缩小为原来的1/2,体系重新达到平衡,体系压强变化如图丙所示。 将一定量的NO2充入针筒中后封口,发生反应2NO2 (g)
2BaO(s)+O2(g)达到平衡时体系压强为P.,保持温度不变,t0时刻将容器体积缩小为原来的1/2,体系重新达到平衡,体系压强变化如图丙所示。 将一定量的NO2充入针筒中后封口,发生反应2NO2 (g)  N2O4(g),图丁表示在拉伸和压缩针筒活塞的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。则c点与a点相比,c(NO2)增大,c(N2O4)减小。
N2O4(g),图丁表示在拉伸和压缩针筒活塞的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。则c点与a点相比,c(NO2)增大,c(N2O4)减小。
 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系