你可能感兴趣的试题
没有合适的指示剂 CaCO3与盐酸反应较慢 CaCO3与盐酸不能定量反应 CaCO3对指示剂有吸附作用
CaCO3→Ca(OH)2→CaO→CaCO3 CaCO3→CaO→Ca(OH)2→CaCO3 C
v逆 c(CO2) 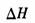
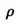 (容器内气体密度)
(容器内气体密度)
按溶解、过滤、蒸发的操作顺序可以分离CaCl2、CaCO3的混合物 向某未知溶液中加入AgNO3溶液,产生白色沉淀,证明溶液是盐酸 用磷在密闭容器中燃烧,除去密闭容器内空气中的氧气 将pH试纸润湿后,用玻璃棒蘸取食用白醋滴到试纸上,测定其pH
Ca2+十HCO3—+OH—=CaCO3↓+H2O. Ca2++H++CO32—+OH—=CaCO3↓+H2O. Ca2++2H++CO32—+2OH—=CaCO3↓+2H2O. Ca2++2HCO3—+2OH—=CaCO3↓+2H2O+CO32—
将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度为原来的2倍 增加CaCO3(s)的量,平衡正向移动,CO2的浓度增大 将体积增大为原来的2倍,再次达到平衡时,气体密度不变 保持容器体积不变,充入He,平衡向逆反应方向进行
将体积缩小为原来的一半,当体系再次达平衡时,CO2浓度为原来的2倍 增加CaCO3(s)的量,平衡正向移动,CO2的浓度增大 将体积增大为原来的2倍,再次达到平衡时,气体密度不变 保持容器体积不变,充入He,平衡向逆反应方向进行
将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度为原来的2倍 CaCO3(s)加热分解生成CaO(s)和CO2(g),△S<0 将体积增大为原来的2倍,再次达到平衡时,气体的密度不变 保持容器体积不变,充入He,平衡向逆反应方向进行
将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度为原来的2倍 CaCO3(s)加热分解生成CaO(s)和CO2(g),△S<0 将容器体积增大为原来的2倍,平衡向正反应方向移动 保持容器体积不变,充入He,平衡向逆反应方向进行
用玻璃棒蘸取白醋滴在润湿pH试纸上,测定其pH 用磷在密闭容器中燃烧,除去密闭容器内空气中的氧气 按溶解、过滤、蒸发的操作顺序可以分离AgCl、CaCO3的混合物 向某溶液中加入氯化钡溶液,产生不溶于稀硝酸的白色沉淀,则该溶液一定是硫酸溶液
干燥和粘土矿物脱水 少量CaCo3分解和固相反应 烧结法和冷却 大量CaCo3分解和固相反应

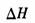
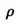 (容器内气体密度)
(容器内气体密度)