你可能感兴趣的试题
常温下,等浓度、等体积的NaHCO3 溶液pH小于 溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和
溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和  溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者  水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
5%Na2CO3、1%NaOH、5%NaOH、5%NaHCO3 5%NaOH、1%NaOH、5%Na2CO2、5%NaHCO3 5%NaHCO3、5%Na2CO3、1%NaOH、5%NaOH 5%Na2CO3、1%NaOH、5%NaHCO3、5%NaOH 5%NaHCO3、5%Na2CO3、5%NaOH、1%NaOH
向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液, 又有CaCO3沉淀生成 向Na2 CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原溶液中Na2CO3的物质 的量之比为1:2 等质量的NaHCO3和Na2 CO3分别与足量稀盐酸反应,在同温同压下,生成的CO2体积相同 向Na2CO3饱和溶液中通入足量CO2,有NaHCO3 结晶析出
c(OH-)前者大于后者 均存在电离平衡和水解平衡 存在的粒子种类相同 溶液中阳离子浓度相同
Na2SO4>NaHCO3>CaCI2>MgSO4 MgSO4>NaHCO3>CaCI2>Na2SO4 CaCI2>NaHCO3>MgSO4>Na2SO4 NaHCO3>CaCI2>MgSO4>Na2SO4
Na2CO3 NaHCO3 NaOH NaOH+Na2CO3 Na2CO3+NaHCO3
常温下,等浓度、等体积的NaHCO3 溶液pH小于 溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和
溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和 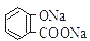 溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者 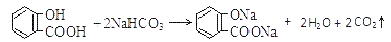 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
5%Na2CO3溶液 5%NaHCO3溶液 5%NaOH溶液 1%NaOH溶液 1%NaHCO3溶液
放Na2CO3的一端托盘下沉 放NaHCO3的端托盘下沉 仍保持平衡 无法判断
酸性:CH3COOH>HSCN>H2CO3 反应结束后所得两溶液中,c(CH3COO-)>c(SCN-) 上述三种溶液中由水电离的c(OH-):NaHCO3>CH3COOH>HSCN CH3COOH溶液和NaHCO3溶液反应所得溶液中: c(CH3COO-) +c(CH3COOH)=0.1 mol·L-1
Na2CO3 NaHCO3 NaCl NH4Cl Na2CO3 NaHCO3 NH4Cl NaCl (NH4)2SO4 NH4Cl NaNO3 Na2S NH4Cl (NH4)2SO4 Na2S NaNO3
5%Na2 CO3溶液 . 5%NaHCO3溶液 5%NaOH溶液 1%NaOH溶液 1%NaHCO3溶液

 溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和
溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和  溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者  水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
 溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和
溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和 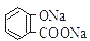 溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者 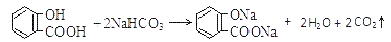 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键