你可能感兴趣的试题
NaOH溶液与三种酸的反应均是吸热反应 酸性强弱: HX>HY>HZ 滴定酸HY可用酚酞作指示剂 滴定三种酸都可用甲基橙作指示剂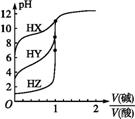
图2是滴定盐酸的曲线 a与b的关系是:a<b E.点对应离子浓度由大到小的顺序是:C.(CH3COO-)>C.(Na+)>c(H+)>C.(OH-) 这两次滴定都可以用甲基橙作指示剂
由图可知HA是一种弱酸,且Ka=1.0×10-5 水电离出的氢离子浓度:a当NaOH溶液的体积为10.00 mL时,有:c(A-)+c(OH-)=c(H+)+c(HA) B点溶液中的离子浓度关系可能为:c(Na+)>c(A-)>c(OH-)>c(H+)
点①所示溶液中:c(CH3COO﹣)+c(OH﹣)=c(CH3COOH)+c(H.+) 点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO﹣) 点③所示溶液中:c(Na+)>c(OH﹣)>c(CH3COO﹣)>c(H.+) 滴定过程中可能出现:c(CH3COOH)>c(CH3COO﹣)>c(H.+)>c(Na+)>c(OH﹣)
0.35molL-1 0.3molL-1 0.15molL-1 0.2molL-1
常温下,HA的电离常数K(HA)约为10-5 v1<20 溶液中水的电离程度:a点>b点 滴定过程为了确定滴定终点,最合适的指示剂是酚酞
加入过量的碘化钾 滴定一般在低温下进行 滴定一般在常温下进行 滴定时不要剧烈摇动溶液
当混合溶液的pH>7时,其中不可能存在HAc分子 当混合溶液的pH<7时,混合液中c(Na+)>c(Ac-) 判断该滴定过程的终点,最好选择甲基橙作为指示剂 达到滴定终点时,混合液中c(Na+)和c(Ac-)一定不相等
左图是滴定盐酸的曲线 E.点时溶液中离子浓度为c(Na+) = c(A.—) B.点时,反应消耗溶液体积:V.(NaOH)>V.(HA) 当0mL<V.(NaOH)<20. 00mL时,溶液中一定是c(A.-)>c(Na+)>c(H+) >c(OH-)
图1可以表示用NaOH溶液滴定1 mol·L-1的稀盐酸 图1可以表示用NaOH溶液滴定1 mol·L-1的稀醋酸 图2可以表示在MgCl2中逐滴加入相同浓度相同体积的NaOH溶液 图2可以表示在稀盐酸中逐滴加入相同浓度相同体积的NaOH溶液 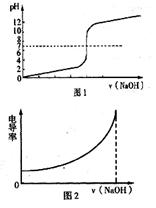
常温下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的电离程度相同 常温下,将pH=3的硫酸和pH=11的氨水等体积混合后,所得溶液的pH>7 常温下,将醋酸溶液与NaOH 溶液等体积混合后,若所得溶液的pH=7,则原溶液中c(CH3COOH)>c(NaOH) 常温下,pH=1的NaHSO4溶液:c(H+)=2c(SO42-)+c(OH-)
将溶液稀释到原体积的2倍 加入适量的醋酸钠固体 加入等体积0.2 molL﹣1盐酸 加少量冰醋酸
常温下,某NaHSO3溶液的pH<7,则该溶液中 25℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,所消耗溶液体积为:V(醋酸溶液)>V(NaOH溶液) 将l mL pH=2的醋酸溶液加水稀释到10 mL,pH变为3 常温下,将Na2CO3溶液加水稀释,
25℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,所消耗溶液体积为:V(醋酸溶液)>V(NaOH溶液) 将l mL pH=2的醋酸溶液加水稀释到10 mL,pH变为3 常温下,将Na2CO3溶液加水稀释, 的值增大
的值增大
X=20 HA溶液加水稀释后,溶液中 的值减小 0.1 mol/L的NaOH溶液中,由水电离出的c(OH−)=0.1 mol/L 加入NaOH溶液体积为X mL时,溶液中c(A−)=0.05 mol/L
的值减小 0.1 mol/L的NaOH溶液中,由水电离出的c(OH−)=0.1 mol/L 加入NaOH溶液体积为X mL时,溶液中c(A−)=0.05 mol/L
图1是滴定CH3COOH 溶液的曲线 图2若用甲基橙作指示剂达到滴定终点时,则溶液由黄色变为红色 点 所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) D.如果C.E.两点对应的pH分别为3、9,则水电离的氢离子浓度之比为1∶100
NaOH溶液与三种酸的反应均是吸热反应 酸性强弱:HX>HY>HZ 滴定酸HY可用酚酞作指示剂 滴定三种酸都可用甲基橙作指示剂 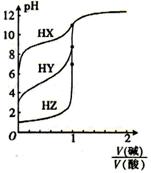



 25℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,所消耗溶液体积为:V(醋酸溶液)>V(NaOH溶液) 将l mL pH=2的醋酸溶液加水稀释到10 mL,pH变为3 常温下,将Na2CO3溶液加水稀释,
25℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,所消耗溶液体积为:V(醋酸溶液)>V(NaOH溶液) 将l mL pH=2的醋酸溶液加水稀释到10 mL,pH变为3 常温下,将Na2CO3溶液加水稀释, 的值增大
的值增大
 的值减小 0.1 mol/L的NaOH溶液中,由水电离出的c(OH−)=0.1 mol/L 加入NaOH溶液体积为X mL时,溶液中c(A−)=0.05 mol/L
的值减小 0.1 mol/L的NaOH溶液中,由水电离出的c(OH−)=0.1 mol/L 加入NaOH溶液体积为X mL时,溶液中c(A−)=0.05 mol/L
