你可能感兴趣的试题
碳的燃烧热小于110.5 kJ/mol ①的反应热为221 kJ/mol 稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol 稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量小于57.3 kJ
酸和碱反应生成1mol水时所放出的热; 1mol酸和1mol碱反应生成盐和水时所放出的热; 强酸稀溶液和强碱稀溶液反应生成1mol液态水时所放出的热; 稀Ba(OH)2和稀H2SO4完全反应生成1mol水时所放出的热。
中和热一定是强酸跟强碱反应放出的热量 1 mol酸与1 mol碱完全反应放出的热量是中和热 在稀溶液中,酸与碱发生中和反应生成1 mol H2O时的反应热叫做中和热 表示中和热的离子方程式为:H+(aq)+OH-(aq)=H2O(l); △H=57.3KJ/mol
10 L 0.05 mol•L﹣1Ba(OH)2溶液与20 L 0.05 mol•L﹣1 HNO3反应时的反应热是中和热
1 mol HCl气体通入1 L 0.01 mol•L﹣1 NaOH溶液中反应时的反应热是中和热
1 mol HClO与2 mol NaOH溶液反应时的反应热也可能是中和热
只要强酸与强碱在稀溶液中反应生成1 mol水时的反应热就是中和热
稀硫酸与稀NaOH溶液的中和热为57.3 kJ/mol ①的反应热为221 kJ/mol 稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
浓的强酸和稀的强碱溶液反应 浓的弱酸和稀的强碱溶液反应 等浓度的强酸和弱碱溶液反应 生成了一种强酸弱碱盐
浓的强酸和稀的强碱溶液反应 浓的弱酸和稀的强碱溶液反应 等浓度的强酸和弱碱溶液反应 生成了一种强酸弱碱盐
碳的燃烧热大于110.5 kJ·mol-1 ①的反应热为221 kJ·mol-1 稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ·mol-1 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
浓的强酸和稀的强碱溶液反应 浓的弱酸溶液和稀的强碱溶液反应 等浓度的强酸和弱碱溶液反应 生成了一种强酸弱碱盐
强酸跟强碱的反应热一定是中和热 1molC完全燃烧放热383.3kJ,其热化学方程为: +O2═CO2 △H=﹣383.3kJ•mol﹣1 C.在稀溶液中,强酸与强碱发生中和反应生成1molH.2O.时的反应热叫做中和热 表示中和热的离子方程式为:H.+(aq)+OH﹣(aq)═H.2O.(l);△H=57.3KJ•mol﹣1
碳的燃烧热大于110.5 kJ/mol ①的反应热为221 kJ/mol 稀硫酸与稀NaOH溶液反应的中和热为114.6 kJ/mol 稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3 kJ热量
中和热一定是强酸跟强碱反应放出的热量 1 mol酸与1 mol碱完全反应放出的热量是中和热 在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时的反应热叫做中和热 测定中和热时可用稀硫酸和稀Ba(OH)2溶液
稀的强酸溶液和浓的强碱溶液反应 浓的弱碱溶液和稀的强酸溶液反应 等浓度的强碱和弱酸溶液反应 一元强酸溶液和二元强碱溶液反应
-69.4 kJ/mol -45.2 kJ/mol +69.4 kJ/mol +45.2 kJ/mol
碳的燃烧热等于110.5 kJ/mol ①的反应热为221 kJ/mol 稀硫酸与稀NaOH溶液反应的中和热ΔH为-57.3 kJ/mol 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
KOH(aq)+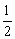 H2SO4(aq)
H2SO4(aq)
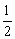 K2SO4(aq)+H2O(l) ΔH.=-57.3 kJ·mol-1 NaOH(aq)+HCl(aq)
K2SO4(aq)+H2O(l) ΔH.=-57.3 kJ·mol-1 NaOH(aq)+HCl(aq)  NaCl(aq)+H2O(l) ΔH.=+57.3 kJ·mol-1 H2SO4和Ca(OH)2反应的中和热为ΔH.=2×(-57.3) kJ·mol-1 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
NaCl(aq)+H2O(l) ΔH.=+57.3 kJ·mol-1 H2SO4和Ca(OH)2反应的中和热为ΔH.=2×(-57.3) kJ·mol-1 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
碳的燃烧热大于110.5 kJ/mol ①的反应热为221 kJ/mol 稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量

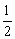 H2SO4(aq)
H2SO4(aq)
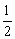 K2SO4(aq)+H2O(l) ΔH.=-57.3 kJ·mol-1 NaOH(aq)+HCl(aq)
K2SO4(aq)+H2O(l) ΔH.=-57.3 kJ·mol-1 NaOH(aq)+HCl(aq)  NaCl(aq)+H2O(l) ΔH.=+57.3 kJ·mol-1 H2SO4和Ca(OH)2反应的中和热为ΔH.=2×(-57.3) kJ·mol-1 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
NaCl(aq)+H2O(l) ΔH.=+57.3 kJ·mol-1 H2SO4和Ca(OH)2反应的中和热为ΔH.=2×(-57.3) kJ·mol-1 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量