你可能感兴趣的试题
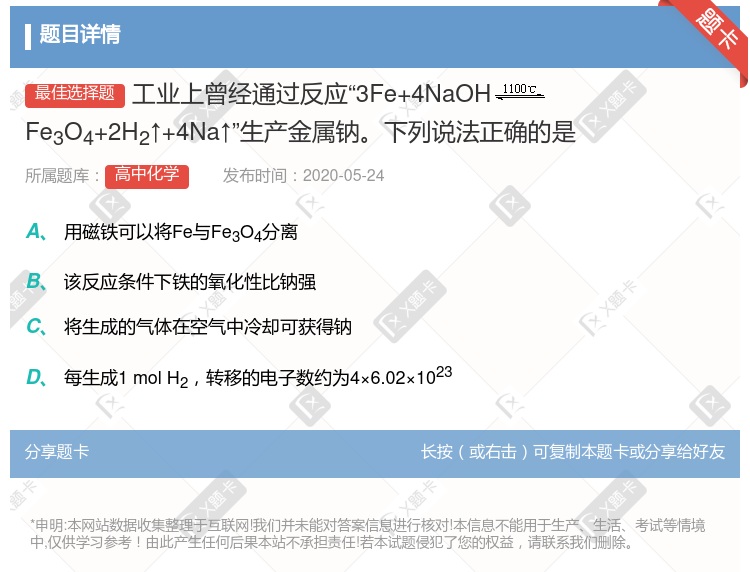
用磁铁可以将Fe与Fe3O4分离 将生成的气体在空气中冷却可获得钠 该反应条件下铁的氧化性比钠强 每生成1 mol H2,转移的电子数约为4×6.02×1023
该反应中NaOH为还原剂 该反应可以在水溶液中进行 将生成的气态物质在空气中冷却可获得钠 每生成22.4L. H2(标准状况),转移的电子数约为4×6.02×1023
12O3,对于该反应,下列说法正确的是 A.Fe是氧化剂 Fe2O3被还原 A.1 发生了还原反应 Fe2O3失去电子
用磁铁可以将Fe与Fe3O4分离 将生成的气体在空气中冷却可获得钠 该反应条件下铁的氧化性比钠强 每生成1molH2,转移的电子数约为4×6.02×1023
3Fe2O3+CO=2Fe3O4+CO2 Fe3O4+CO=3FeO+CO2 3Fe2O3+H2=2Fe3O4+H2O Fe3O4+H2=3FeO+H2O
溶液的pH:①>②>③ 整个过程中Fe2(SO4)3溶液可以循环利用 溶液②转化为溶液③发生反应的离子方程式为4H++4Fe2++O2=4Fe3++2H2O 向②溶液中滴加KSCN溶液,溶液可能变为血红色
FeO+2HCl=FeCl3+H2O Fe2O3+6HCl=2FeCl3+3H2O Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
CuO+H2SO4= CuSO4+H2O FeC13+3NaOH=Fe(OH)3↓+3NaCl Fe+2FeC13=3FeC12 2Al(OH)3 A.12O3+3H2O
A.12O3+3H2O
磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+8H+=Fe2++2Fe3++4H2O 向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+ 向NaHSO4溶液中滴加Ba(OH)2溶液至不再产生沉淀:Ba2++2OH-+2H++SO42-=BaSO4+2H2O 向KMnO4溶液中通入过量的SO2气体:5SO2+2MnO4-+4H+=2Mn2++5SO42-+2H2O
用磁铁可以将Fe 与Fe3O4分离 将生成的气体在空气中冷却可获得钠 该反应中的氧化剂NaOH 每生成22.4LH2,转移的电子数一定为4×6.02×1023
澄清石灰水与盐酸反应:H+ + OH- = H2O 把金属铁放入稀H2SO4中反应:2Fe + 6H+ = 2Fe3+ + 3H2 ↑ H2SO4与Ba(OH)2溶液反应:Ba2+ + H+ + OH-+ SO42—= BaSO4↓+ H2O AlCl3溶液中加入过量的浓氨水:Al3+ + 4NH3·H2O = AlO2-+ 4NH4+ + 2H2O
不能用磁铁将Fe与Fe3O4分离 将生成的气体在空气中冷却可获得钠 该反应条件下铁的氧化性比钠强 该反应中每生成2 mol H2,转移的电子数约为4×6.02×1023
稀硫酸滴到铁片上: 2Fe +6H.+=2 Fe3++ 3H2↑ 硫酸铜溶液与氢氧化钠溶液混合: CuSO4 +2 O.H.-= Cu(OH)2↓+ SO42- FeCl3溶液与氨水反应: Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+ 钠与水反应: Na+2H2O=Na++2OH-+H.2↑
每生成1mol H2 ,转移的电子数约为4NA 增大铁的量可以使反应速率加快 该反应条件下铁的金属性比钠强 将生成的气体在空气中冷却可获得钠
 A.12O3+3H2O
A.12O3+3H2O