你可能感兴趣的试题
用磁铁可以将Fe与Fe3O4分离 该反应条件下铁的氧化性比钠强 将生成的气体在空气中冷却可获得钠 每生成1 mol H2,转移的电子数约为4×6.02×1023
用磁铁可以将Fe与Fe3O4分离 将生成的气体在空气中冷却可获得钠 该反应条件下铁的氧化性比钠强 每生成1 mol H2,转移的电子数约为4×6.02×1023
该反应中NaOH为还原剂 该反应可以在水溶液中进行 将生成的气态物质在空气中冷却可获得钠 每生成22.4L. H2(标准状况),转移的电子数约为4×6.02×1023
3NO2+H2O===2HNO3+NO 2Na2O2+2H2O===4NaOH+O2↑ 4Fe(OH)2+2H2O+O2===4Fe(OH)3 3Fe+4H2O(g) Fe3O4+4H2
Fe3O4+4H2
用磁铁可以将Fe与Fe3O4分离 将生成的气体在空气中冷却可获得钠 该反应条件下铁的氧化性比钠强 每生成1molH2,转移的电子数约为4×6.02×1023
HCl+NaOH= NaCl+H2O ΔH.<0 2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(l) ΔH.<0 4Fe(OH)2(s)+2H2O(l)+O2(g) = 4 Fe(OH)3(s) ΔH.<0 2H2(g)+O2(g) =2H2O(l) ΔH.<0
3Fe2O3+CO=2Fe3O4+CO2 Fe3O4+CO=3FeO+CO2 3Fe2O3+H2=2Fe3O4+H2O Fe3O4+H2=3FeO+H2O
FeO+2HCl=FeCl3+H2O Fe2O3+6HCl=2FeCl3+3H2O Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
Fe3O4+H2+H2S===3FeS+4H2O Fe3O4+H2+3H2S===3FeS+4H2O Fe3O4+H2+3H2S===FeS+4H2O Fe3O4+2H2+3H2S===3FeS+4H2O
Na与FeSO4溶液常温混合 CO通过灼热的Fe2O3 H2通入FeSO4溶液 H2和Fe3O4加热条件下反应
用磁铁可以将Fe 与Fe3O4分离 将生成的气体在空气中冷却可获得钠 该反应中的氧化剂NaOH 每生成22.4LH2,转移的电子数一定为4×6.02×1023
反应⑴和⑵均为氧化还原反应 反应⑴的氧化剂是O.2,还原剂是FeO·Cr2O.3 高温下,O.2的氧化性大于Fe2O.3小于Na2CrO4 生成1mol的Na2Cr2O.7时共转移7mol电子
反应(1)和(2)均为氧化还原反应 反应(1)的氧化剂是O2,还原剂是FeO·Cr2O3 高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4 反应(1)中每生成1molNa2CrO4时电子转移3mol
每生成1mol H2 ,转移的电子数约为4NA 增大铁的量可以使反应速率加快 该反应条件下铁的金属性比钠强 将生成的气体在空气中冷却可获得钠
不能用铁器盛放硫酸铜溶液的原因:Fe+CuSO4=FeSO4+Cu 置换反应 铝耐腐蚀的原因: 4Al+3O2=Al2O3 氧化反应 工业上以赤铁矿为原料冶炼生铁:2Fe2O3+3C  4Fe+ 3CO2↑ 还原反应
4Fe+ 3CO2↑ 还原反应
电解水产生氢气和氧气 2H2O  2H2↑+ O2 ↑ 分解反应
2H2↑+ O2 ↑ 分解反应
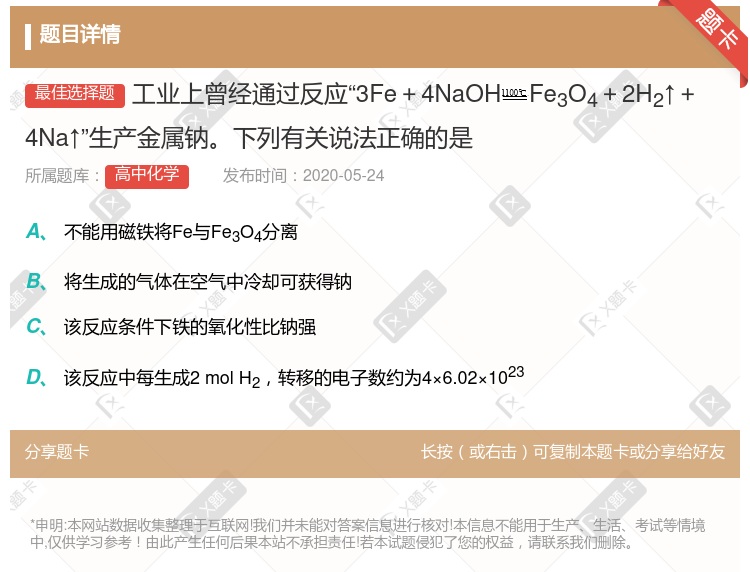
 Fe3O4+4H2
Fe3O4+4H2
 4Fe+ 3CO2↑ 还原反应
4Fe+ 3CO2↑ 还原反应 2H2↑+ O2 ↑ 分解反应
2H2↑+ O2 ↑ 分解反应