你可能感兴趣的试题
放热反应不必加热就一定能发生 应用盖斯定律,可以计算某些难于直接测量的反应的反应热 △H.大于零的反应是放热反应 生成物总能量一定低于反应物总能量
生成物总能量一定低于反应物总能量 放热反应的反应速率总是大于吸热反应的反应速率 应用盖斯定律,可计算某些难以直接测量的反应的反应热 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
生成物总能量一定低于反应物总能量 放热反应的反应速率总是大于吸热反应的反应速率 应用盖斯定律,可以计算某些难于直接测量的反应的反应热 △H大于零的反应是放热反应
不管反应是一步完成还是分几步完成,其反应热相同 反应热只与反应体系的始态和终态有关,而与反应的途径无关 有些反应的反应热不能直接测得,可通过盖斯定律间接计算得到 根据盖斯定律,热化学方程式中△H直接相加即可得总反应热
P4(白磷,s)=4P(红磷,s)△H=﹣29.2kJ/mol P4(白磷,s)=4P(红磷,s)△H=+29.2kJ/mol P4(白磷,s)=4P(红磷,s)△H=﹣2244.7kJ/mol P4(白磷,s)=4P(红磷,s)△H=+2244.7kJ/mol
﹣YkJ/mol ﹣(10X﹣Y)kJ/mol
﹣(5X﹣0.5Y)kJ/mol +(10X﹣Y)kJ/mol
石油、沼气、天然气、植物油都属于可再生能源 应用盖斯定律,可计算某些难以直接测量的反应的焓变 水蒸气变为液态水时放出的能量就是该变化的反应热 同温同压下,H2(g)+Cl2(g)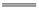 2HCl(g)在光照和点燃条件下的ΔH不同
2HCl(g)在光照和点燃条件下的ΔH不同
石油、沼气、天然气、植物油都属于可再生能源 应用盖斯定律,可计算某些难以直接测量的反应的焓变 水蒸气变为液态水时放出的能量就是该变化的反应热 同温同压下,H2(g)+Cl2(g)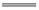 2HCl(g)在光照和点燃条件下的ΔH不同
2HCl(g)在光照和点燃条件下的ΔH不同
化学反应的热效应与反应途径无关 化学反应的热效应与反应的起始状态和最终状态有关 应用盖斯定律,可计算某些难以直接测量热效应的反应 盖斯定律只适用于化学反应的能量变化,不适用于物质聚集状态转化时能量变化
-Y kJ・mol-1 -(10X-Y)kJ・mol-1 -(5X-0.5Y) kJ・mol-1 +(10X-Y) kJ・mol-1
不管反应是一步完成还是分几步完成,其反应热相同
反应热只与反应体系的始态和终态有关,而与反应的途径无关
有些反应的反应热不能直接测得,可通过盖斯定律间接计算得到
根据盖斯定律,热化学方程式中△H直接相加即可得总反应热
石油、沼气、天然气、植物油都属于可再生能源 水蒸气变为液态水时放出的能量就是该变化的反应热 应用盖斯定律,可计算某些难以直接测量的反应焓变 同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH.不同
1mol碳燃烧生成CO时所放出的热量就是碳的燃烧热 从化石能源到能源的多元化,其中氢能属于不可再生能源 放热反应可以自发进行,而吸热反应需加热才能进行 应用盖斯定律,可计算某些难以直接测量的反应焓变
P4(白磷,s)=4P(红磷,s) △H=-29.2kJ·mol-1 P4(白磷,s)=4P(红磷,s) △H=+29.2kJ·mol-1 P4(白磷,s)=4P(红磷,s) △H=-2244.7kJ·mol-1 P4(白磷,s)=4P(红磷,s) △H=+2244.7kJ·mol-1
石油、沼气、天然气、植物油都属于可再生能源 应用盖斯定律,可计算某些难以直接测量的反应的焓变 水蒸气变为液态水时放出的能量就是该变化的反应热 同温同压下,H2(g)+Cl2(g)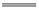 2HCl(g)在光照和点燃条件下的ΔH不同
2HCl(g)在光照和点燃条件下的ΔH不同
反应热和焓变的单位都是kJ 如果反应是在恒温恒压条件下进行的,此时的反应热与焓变相等 如果反应是在恒温恒容条件下进行的,此时的反应热与焓变相等 任何化学反应的反应热均可通过实验直接测定
不管反应是一步完成还是分几步完成,其反应热相同 反应热只与反应体系的始态和终态有关,而与反应的途径无关 有些反应的反应热不能直接测得,可通过盖斯定律间接计算得到 根据盖斯定律,热化学方程式中△H.直接相加即可得总反应热
-YkJ/mol -(10X-Y.)kJ/mol -(5X-0.5Y)kJ/mol +(10X-Y.)kJ/mol

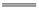 2HCl(g)在光照和点燃条件下的ΔH不同
2HCl(g)在光照和点燃条件下的ΔH不同
 2HCl(g)在光照和点燃条件下的ΔH不同
2HCl(g)在光照和点燃条件下的ΔH不同
 2HCl(g)在光照和点燃条件下的ΔH不同
2HCl(g)在光照和点燃条件下的ΔH不同