你可能感兴趣的试题
0.1 mol锌片投入到100 mL 1 mol・L-1的盐酸溶液中 1 mol MnO2粉末与400 mL10 mol・L-1的盐酸共热 常温下1mol铝片投入到200mL18.4mol・L-1硫酸中 常温下 1 mol铜片投入含4molHNO3的浓硝酸中
中和10 mL 0.1 mol·L-1 醋酸与中和100 mL 0.01 mol·L-1的醋酸所需同种碱溶液的量不同 常温下,等体积的pH=3的酸溶液和pH=11的碱溶液混合,混合后溶液的pH=7 常温下,体积相等、pH相同的盐酸和硫酸溶液,两溶液溶质的物质的量浓度相等 常温下,pH=3的甲酸溶液的c(H+)与pH=11的氨水溶液的c(OH-)相等
0.1 mol/L的NaOH溶液滴定锥形瓶中的稀盐酸,用酚酞做指示剂滴定到终点 pH=6的醋酸用水稀释100倍 pH=10的氢氧化钠溶液稀释1000倍 0.1 mol/L的硫酸100 mL与0.1 mol/L NaOH溶液150 mL充分反应
图2是滴定盐酸的曲线 a与b的关系是:aE.点对应离子浓度由大到小的顺序为: c(CH3COO-)>c(Na+)>c(H+)>c(OH-) 这两次滴定都可以用甲基橙作为指示剂且颜色变化为红变橙
图1是滴定CH3COOH 溶液的曲线 图2若用甲基橙作指示剂达到滴定终点时,则溶液由黄色变为红色 点 所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) D.如果C.E.两点对应的pH分别为3、9,则水电离的氢离子浓度之比为1∶100
曲线①代表0.1 mol/L KOH溶液滴定CH3COOH溶液的滴定曲 线,曲线②代表0.1 mol/L KOH溶液滴定HCl溶液的滴定 曲线 在相同温度下, 点水电离的c(H+)大于A.点水电离的c(H+) C.在A.点的溶液中有:c(CH3COO—)+ c(OH—)﹣c(H+)= 0.05 mol/L 在B.点的溶液中有:c(K+)> c(OH—)> c(CH3COO—)> c(H+)
某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a﹥b 在滴有酚酞的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 常温下,1.0×10-3 mol·L-1盐酸的pH=3.0,1.0×10-8 mol·L-1盐酸的pH=8.0 常温下,若1 mL pH=1的盐酸与100 mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11
pH=6.5的溶液一定显酸性 0.1mol • L-1的Na2CO3溶液中:c(CO32-)+c(HCO3-)=0.1mol • L-1 常温下,等体积的0.2 mol • L-1的盐酸与0.2 mol • L-1的氢氧化钡溶液混合,所得溶液的pH=13 常温下,某溶液中水电离出的c(OH-)=l×10-12 mol • L-1,该溶液pH 一定等于2
常温下,20mL中含X.、Y.各0.003mol的溶液 常温下,100mL中含X.、Y.各0.005mol的溶液 常温下,0.1mol/L.的X.、Y.溶液各l0mL相混合 标准状况下,0.1mol/L.的X.、Y.溶液各l0mL相混合
常温下,HA的电离常数K(HA)约为10-5 v1<20 溶液中水的电离程度:a点>b点 滴定过程为了确定滴定终点,最合适的指示剂是酚酞
(10-8+10-10)/2 mol/L (10-8+10-10)mol/L
(10-14-5×10-5)mol/L 2×10-10 mol/L
常温下,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 常温下,将pH =10的氨水稀释后,溶液中所有离子浓度都减小 常温下,0.1 mol/L Na2S溶液中存在:c(OH-) = c(H+) + c(HS-) + c(H2S) 常温下,pH为1的0.1 mol/L HA溶液与0.1 mol/L NaOH溶液恰好完全反应时,溶液中一定存在: c (Na+) = c(A-) > c(OH-) = c(H+)
图1可以表示用NaOH溶液滴定1 mol·L-1的稀盐酸 图1可以表示用NaOH溶液滴定1 mol·L-1的稀醋酸 图2可以表示在MgCl2中逐滴加入相同浓度相同体积的NaOH溶液 图2可以表示在稀盐酸中逐滴加入相同浓度相同体积的NaOH溶液 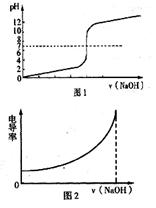
点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) 溶液中②、③点水的电离程度:③>② 点②所示溶液中:c(Na+)=c(CH3COO-)=c(H+)=c(OH-) 该滴定过程应该选择甲基橙作为指示剂
pH=2和pH=1的硝酸中c(H+)之比为10∶1 pH=12的Ba(OH)2溶液与pH=12的KOH溶液中溶质的物质的量浓度之比1:2 0.2 mol·L-1 的CH3COOH溶液与0.1 mol·L-1的盐酸中c(H+)之比2:1 常温下,将pH均为12的氨水和NaOH溶液分别加水稀释100倍后,NaOH溶液的 pH较大
图1是滴定CH3COOH 溶液的曲线 图2若用甲基橙作指示剂达到滴定终点时,则溶液由黄色变为红色 点 所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) D.如果C.E.两点对应的pH分别为3、9,则水电离的氢离子浓度之比为1∶100
常温下,pH等于14与pH等于12的两种NaOH溶液等体积混合后, c(H+)=(10-14+10-10)/2 常温下,浓度为1×10-10 mol·L.-1的KOH溶液的pH为7 氨水加水稀释,溶液中除水以外的所有粒子的浓度都减小 常温下,pH等于1的盐酸溶液中水的电离程度与pH等于13的Ba(OH)2溶液中水的电离程度相等

