你可能感兴趣的试题
NaHA:c(Na+)>c(HA-)>c(OH-)>c(A.-)>c(H+) Na2A:c(Na+)= 2[c(A2-)+ c(HA-)+ c(H2A)] Na2A:c(H+)+ c(HA-)+ 2c(H2A)= c(OH-) H2A:c(H+)= c(HA-)+ 2c(A2-)+ c(OH-)
H2A在水溶液中的电离方程式为:H2A=H++HA-,HA- H++A2- 常温下,NH4HA溶液中滴加NaOH溶液至溶液pH=7,则c(Na+) = 2c(A2-) 相同条件下,体积相等、pH相等的盐酸与H2A溶液中和NaOH的量相等 0.0l mol·L-l的NaHA溶液pH>2
H++A2- 常温下,NH4HA溶液中滴加NaOH溶液至溶液pH=7,则c(Na+) = 2c(A2-) 相同条件下,体积相等、pH相等的盐酸与H2A溶液中和NaOH的量相等 0.0l mol·L-l的NaHA溶液pH>2
H2A是弱酸 稀释0.1 mol/L H2A溶液,因电离平衡向右移动而导致c(H+ )增大 在0.1 mol/L的H2A溶液中,c(H+)=0.12 mol/L 若0.1 mol/L NaHA溶液中c(H+)=0.02 mol/L,则0.1 mol/L的H2A中c(H+)< 0.12 mol/L
2-)所示。根据图示判断,下列说法正确的是( ) A.当V(NaOH)=20 mL时,溶液中离子浓度大小 关系:c(Na+)>c(HA-)> c(A2-) > c(H+) >c(OH-) 等浓度的NaOH溶液与H2A溶液按2:1混合后, 其溶液中水的电离程度比纯水大 NaHA溶液中:c(OH—)=c(H+)+c(HA–)+2c(H2A) 向上述加入20mLNaOH溶液后所得溶液中再加入水的过程中,pH可能减少
NaHA:c(Na+)>c(HA-)>c(OH-)>c(H.+) NaHA:c(Na+)=c(A2-)+c(HA-)+c(H2A) Na2A: c(Na+)>c(A2-)>c(OH-)>c(H.+) H2A: c(H.+)=c(HA-)+2 c(A2-)+c(OH-)
在溶液中发生电离:H2A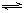 H++HA-,HA-
H++HA-,HA- H++A2-。下列叙述不正确的是()。
H++A2-。下列叙述不正确的是()。
A.在NaHA溶液中,一定是c(Na+)>c(HA-)>
c(OH-)>c(H+)
在Na2A.溶液中,一定是c(Na+)> c(A2-)>c(OH-)>c(H+)
在NaHA溶液中,c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
在H2A.溶液中,c(H+)=c(HA-)+c(OH-)+2c(A2-)
====H++HA- HA- H.++A2- 在0.1mol·L-1Na2A溶液中存在的粒子,其浓度关系正确的是( ) A.c(Na+)+ c(H+)= c(O.H.-)+ c(HA-)+ c(A.2-) c(Na+)+ c(O.H.-)= c(H+)+ c(HA-) c(Na+)=2 c(A.2-)+2 c(HA-)+2 c(H.2A.) c(A.2-) + c(HA-)=0.1 mol·L-1
H.++A2- 在0.1mol·L-1Na2A溶液中存在的粒子,其浓度关系正确的是( ) A.c(Na+)+ c(H+)= c(O.H.-)+ c(HA-)+ c(A.2-) c(Na+)+ c(O.H.-)= c(H+)+ c(HA-) c(Na+)=2 c(A.2-)+2 c(HA-)+2 c(H.2A.) c(A.2-) + c(HA-)=0.1 mol·L-1
粒子(H2A.HA-、A2-)的物质的量分数随pH变化的关系如图所示,下列说法正确的是( ) A.H2A的电离方程式:H2A H.++HA- pH=5时,在NaHA和Na2A的混合溶液中:c(HA-)∶c(A2-)=1∶100 等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为 c(Na+)>c(HA-)>c(A2-) Na2A溶液中必存在c(OH-)=c(H+)+c(HA-)+2c(H2A.),各粒子浓度均大于0
H.++HA- pH=5时,在NaHA和Na2A的混合溶液中:c(HA-)∶c(A2-)=1∶100 等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为 c(Na+)>c(HA-)>c(A2-) Na2A溶液中必存在c(OH-)=c(H+)+c(HA-)+2c(H2A.),各粒子浓度均大于0
NaHA:c(Na+)>c(HA-)>c(OH-)>c(A.-)>c(H+) Na2A:c(Na+)= 2[c(A2-)+ c(HA-)+ c(H2A)] Na2A:c(H+)+ c(HA-)+ 2c(H2A)= c(OH-) H2A:c(H+)= c(HA-)+ 2c(A2-)+ c(OH-)
元素的有关微粒的物质的量变化如下图。根据图示判断,下列说法正确的是  A.H2A在水中的电离方程式是:H2A===H++HA-、HA-
A.H2A在水中的电离方程式是:H2A===H++HA-、HA- H++A.2- 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-) 当V(NaOH)=20 mL时,溶液中各粒子浓度的大小顺序为c(Na+)>c(HA-)>c(H+)> c(OH-)
H++A.2- 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-) 当V(NaOH)=20 mL时,溶液中各粒子浓度的大小顺序为c(Na+)>c(HA-)>c(H+)> c(OH-)
NaHA:c(Na+)>c(HA-)>c(H+)>c(OH-) NaHA:c(Na+)=c(A2-)+c(HA-)+c(H2A.) Na2A: c(Na+)>c(A2-)>c(OH-)>c(H+) H2A: c(H+)=c(HA-)+2 c(A2-)+c(OH-)
因为A2-+H2O  HA-+OH-,所以Na2A溶液显碱性 0.1mol・L-1 H2A溶液中氢离子的物质的量浓度为0.11 mol・L-1 NaHA溶液中各种离子浓度的关系是c(Na+)>c(HA-)>c(H+)>c(A2-)> c(OH-) 在NaHA溶液中,HA-电离的趋势大于其水解的趋势
HA-+OH-,所以Na2A溶液显碱性 0.1mol・L-1 H2A溶液中氢离子的物质的量浓度为0.11 mol・L-1 NaHA溶液中各种离子浓度的关系是c(Na+)>c(HA-)>c(H+)>c(A2-)> c(OH-) 在NaHA溶液中,HA-电离的趋势大于其水解的趋势
在NaHA溶液中一定是c(Na+)>c(HA-)c(OH-)>c(H+) 在Na2A溶液中一定是c(Na+)>c(A2-)C>(OH-)>c(H+) 在NaHA溶液中,c(Na+)+c(H+)=c(HA-)+2c(A2-)+C(OH-) 在Na2A溶液中,c(H+)=c(HA-)+2c(A2-)+C(OH-)
若NaHA的水溶液呈酸性,则二元酸H2A一定是强酸 若NaHA的水溶液呈碱性,则HA-只发生水解 无论H2A是强酸还是弱酸,NaHA溶液中Na+和HA-的个数之比都是1∶1 无论H2A是强酸还是弱酸,NaHA晶体中的阴、阳离子个数比都是1∶1
NaHA:c(Na+)>c(HA-)>c(OH-)>c(H+) NaHA:c(Na+)=c(A2-)+c(HA-) Na2A:c(Na+)>c(A2-) >c(OH-)>c(H+) H2A:c(H+)=c(HA-)+2 c(A2-)+c(OH-)

 H++A2- 常温下,NH4HA溶液中滴加NaOH溶液至溶液pH=7,则c(Na+) = 2c(A2-) 相同条件下,体积相等、pH相等的盐酸与H2A溶液中和NaOH的量相等 0.0l mol·L-l的NaHA溶液pH>2
H++A2- 常温下,NH4HA溶液中滴加NaOH溶液至溶液pH=7,则c(Na+) = 2c(A2-) 相同条件下,体积相等、pH相等的盐酸与H2A溶液中和NaOH的量相等 0.0l mol·L-l的NaHA溶液pH>2
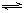 H++HA-,HA-
H++HA-,HA- H++A2-。下列叙述不正确的是()。
H++A2-。下列叙述不正确的是()。 H.++A2- 在0.1mol·L-1Na2A溶液中存在的粒子,其浓度关系正确的是( ) A.c(Na+)+ c(H+)= c(O.H.-)+ c(HA-)+ c(A.2-) c(Na+)+ c(O.H.-)= c(H+)+ c(HA-) c(Na+)=2 c(A.2-)+2 c(HA-)+2 c(H.2A.) c(A.2-) + c(HA-)=0.1 mol·L-1
H.++A2- 在0.1mol·L-1Na2A溶液中存在的粒子,其浓度关系正确的是( ) A.c(Na+)+ c(H+)= c(O.H.-)+ c(HA-)+ c(A.2-) c(Na+)+ c(O.H.-)= c(H+)+ c(HA-) c(Na+)=2 c(A.2-)+2 c(HA-)+2 c(H.2A.) c(A.2-) + c(HA-)=0.1 mol·L-1
 H.++HA- pH=5时,在NaHA和Na2A的混合溶液中:c(HA-)∶c(A2-)=1∶100 等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为 c(Na+)>c(HA-)>c(A2-) Na2A溶液中必存在c(OH-)=c(H+)+c(HA-)+2c(H2A.),各粒子浓度均大于0
H.++HA- pH=5时,在NaHA和Na2A的混合溶液中:c(HA-)∶c(A2-)=1∶100 等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为 c(Na+)>c(HA-)>c(A2-) Na2A溶液中必存在c(OH-)=c(H+)+c(HA-)+2c(H2A.),各粒子浓度均大于0
 A.H2A在水中的电离方程式是:H2A===H++HA-、HA-
A.H2A在水中的电离方程式是:H2A===H++HA-、HA- H++A.2- 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-) 当V(NaOH)=20 mL时,溶液中各粒子浓度的大小顺序为c(Na+)>c(HA-)>c(H+)> c(OH-)
H++A.2- 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-) 当V(NaOH)=20 mL时,溶液中各粒子浓度的大小顺序为c(Na+)>c(HA-)>c(H+)> c(OH-)
 HA-+OH-,所以Na2A溶液显碱性 0.1mol・L-1 H2A溶液中氢离子的物质的量浓度为0.11 mol・L-1 NaHA溶液中各种离子浓度的关系是c(Na+)>c(HA-)>c(H+)>c(A2-)> c(OH-) 在NaHA溶液中,HA-电离的趋势大于其水解的趋势
HA-+OH-,所以Na2A溶液显碱性 0.1mol・L-1 H2A溶液中氢离子的物质的量浓度为0.11 mol・L-1 NaHA溶液中各种离子浓度的关系是c(Na+)>c(HA-)>c(H+)>c(A2-)> c(OH-) 在NaHA溶液中,HA-电离的趋势大于其水解的趋势