你可能感兴趣的试题
pH = 0的NaHSO4溶液 0.04 mol·L-1 硫酸 0.5 mol·L-1 盐酸 0.05 mol·L-1硝酸
NaOH溶液与三种酸的反应均是吸热反应 酸性强弱: HX>HY>HZ 滴定酸HY可用酚酞作指示剂 滴定三种酸都可用甲基橙作指示剂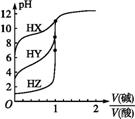
0.1 mol•L-1NaHCO3溶液: K+、Fe3+、Cl-、NO3- 使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Na+ 常温下由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Mg2+、Na+、SO32-、NO3- 常温下在c(H+)=1×10-13mol·L-1的溶液中: Na+、K+、SO42-、CO32-
pH=6.5的溶液一定显酸性 0.1mol • L-1的Na2CO3溶液中:c(CO32-)+c(HCO3-)=0.1mol • L-1 常温下,等体积的0.2 mol • L-1的盐酸与0.2 mol • L-1的氢氧化钡溶液混合,所得溶液的pH=13 常温下,某溶液中水电离出的c(OH-)=l×10-12 mol • L-1,该溶液pH 一定等于2
HX是强酸,溶液每稀释10倍,pH始终增大1 常温下HY的电离常数为1.0×10-4 溶液中水的电离程度:a点大于b点 c点溶液中:c(Na+)>c(Y-)>c(HY)>c(H+)>c(OH-)
HX、HY都是弱酸,且HX的酸性比HY的弱 常温下,由水电离出的c(H+)·c(OH-):a相同温度下,电离常数K.(HX):a>b lg =3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则
=3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则 减小
减小
若a>b,测得c(X-)=c(Y-),可推出溶液中的c(HX)>c(HY) 若a>b,测得c(X-)=c(Y-),可推出溶液中的c(HX)=c(HY) 若a=b,且pH(NaX溶液)>pH(NaY溶液),则相同浓度时,酸性HX<HY 若a=b,并测得a=c(X-)=c(Y-)+c(HY),则HX是强酸,HY是弱酸
c(Na+)-c(X-)=9.9×10-7mol·L-1 c(Na+)=c(X-)+c(HX)=0.2 mol·L-1 c(OH-)-c(HX)=c(H+)=1×10-6mol·L-1 混合溶液中由水电离出的c(OH-)=10-8mol·L-1
HX、HY都是弱酸,且HX的酸性比HY的弱 常温下,由水电离出的c(H+)·c(OH-):a<b 相同温度下,电离常数K.(HX):a>b lg 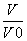 = 3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则
= 3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则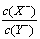 减小
减小
1∶10∶100∶1000 0∶1∶12∶11 14∶13∶12∶11 14∶13∶2∶3


 =3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则
=3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则 减小
减小
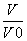 = 3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则
= 3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则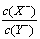 减小
减小