你可能感兴趣的试题
pH=10的NaOH溶液和pH=4的盐酸溶液中,水的电离程度 将pH=3的盐酸和醋酸分别稀释成pH=5的溶液,需加水的体积 10 mL 0.1 mol·L-1的醋酸与100 mL 0.01 mol·L-1的醋酸中的H+物质的量 等体积pH相等的醋酸和盐酸,分别与过量的锌粉反应产生的H2的质量
①>②>③>④>⑤
②>①>③>④>⑤
②>③>④>①>⑤
⑤>④>③>②>①
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H.+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大 25℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O
CH3COO-+H.+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大 25℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O H++OH-逆向移动,c(H+)降低 取c(H+)=0.01 mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO3-)
H++OH-逆向移动,c(H+)降低 取c(H+)=0.01 mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO3-)
将1L. 0.1mol・L-1的Ba(OH)2溶液加水稀释为2L,pH=13 pH=3的醋酸溶液加水稀释100倍,pH=5 pH=4的H2SO4加水稀释100倍,溶液中由水电离产生的[H+]=1×10-6mol・L-1 pH=8的NaOH溶液加水稀释100倍,其pH=6
10mL0.1mol・L-1氨水与10mL0.1mol・L-1盐酸混合:[Cl-]>[NH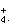 ]>[OH-]>[H+]
]>[OH-]>[H+]
10mL0.1mol・L-1NH4Cl溶液与5mL0.2mol・L-1NaOH溶液混合:[Na+]=[Cl-]>[OH-]>[H+]
10mL0.1mol・L-1CH3COOH溶液与5mL0.2mol・L-1NaOH溶液混合:[Na+]=[CH3COO-]>[OH-]>[H+]
10mL0.5mol・L-1CH3COONa溶液与6mL1mol・L-1盐酸混合:[Cl-]>[Na+]>[OH-]>[H+]
中和时所需NaOH的量
H+的物质的量
CH3COOH的物质的量
溶液的导电能力
自来水 0.5mol・L-1盐酸
0.5mol・L-1醋酸 0.5mol・L-1NH4Cl溶液
⑤ ③ ④ ② ① ① ② ③ ⑤ ④ ① ② ③ ④ ⑤ ⑤ ③ ④ ① ②
中和时所需NaOH的量 电离程度 H+的物质的量 CH3COOH的物质的量
0.21mol・L-1 0.56mol・L-1
0.42mol・L-1 0.26mol・L-1
自来水 0.5mol・L-1盐酸
0.5mol・L-1醋酸 0.5mol・L-1氨水
0. 05mol•L-1的H2SO4溶液,pH=l 0. 001mol•L-1的NaOH溶液,pH = 11 0. 005mol•L-1的H2SO4溶液与0.01mol•L-1的NaOH溶液等体积混合,混合溶液的pH为6,溶液显酸性 完全中和pH = 3的H2SO4溶液50 mL,需要pH = 11的NaOH溶液50 mL
0.01mol ・L-1醋酸溶液 0.02mol ・L-1醋酸与0.02mol ・L-1NaOH溶液等体积混合液 0.03mol ・L-1醋酸与0.01mol ・L-1NaOH溶液等体积混合液 pH = 2的盐酸与pH = 12的NaOH溶液等体积混合液

 CH3COO-+H.+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大 25℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O
CH3COO-+H.+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大 25℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O H++OH-逆向移动,c(H+)降低 取c(H+)=0.01 mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO3-)
H++OH-逆向移动,c(H+)降低 取c(H+)=0.01 mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO3-)
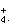 ]>[OH-]>[H+]
]>[OH-]>[H+]