你可能感兴趣的试题
一个化学反应是否能在常温下发生与该反反应的△H.值的大小没有必然联系
中和热△H=-57.3kJ・mol-1,所以,1.00L 1.00mol・L.-1H2SO4与稀的NaOH溶液恰好完全反应放出57.3kJ的热量
用等体积的0.50mol・L.-1盐酸、0.55mol・L.-1NaOH溶液进行中和热测定的实验,会使测得的值偏大
在101KPa时,1molCH4完全燃烧生成CO2和水蒸气放出的热量就是CH4的燃烧热
4g NaOH
2.8g KOH
50mL 0.5mol・L-1 Ba(OH)2溶液
100mL 0.25mol・L-1KOH溶液
2×10-10mol・L-1 (10-8+10-10)mol・L-1/2
(10-8+10-10)mol・L-1 (1×10-14-5×10-5)mol・L-1
用HR做导电实验,灯泡很暗
0.1mol・L-1HR溶液稀释到100倍时,溶液的pH为3.1
20mL0.1mol・L-1HR恰好中和20mL0.1mol・L-1NaOH溶液
0.1mol・L-1NH4R溶液的pH等于7
10mL0.1mol・L-1氨水与10mL0.1mol・L-1盐酸混合:[Cl-]>[NH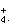 ]>[OH-]>[H+]
]>[OH-]>[H+]
10mL0.1mol・L-1NH4Cl溶液与5mL0.2mol・L-1NaOH溶液混合:[Na+]=[Cl-]>[OH-]>[H+]
10mL0.1mol・L-1CH3COOH溶液与5mL0.2mol・L-1NaOH溶液混合:[Na+]=[CH3COO-]>[OH-]>[H+]
10mL0.5mol・L-1CH3COONa溶液与6mL1mol・L-1盐酸混合:[Cl-]>[Na+]>[OH-]>[H+]
稀HCl和稀NaOH 1.0 mol・L-1 HCl和1.0 mol・L 1 NaOH 500 mL 2.0 mol・L-1 HCl和500 mL2.0 mol・L 1 NaOH 500 mL 2.0 mol・L-1 H2SO4和500 mL 2.0 mol・L-1 Ba(OH)2
0.2 mol・L.-1 0.5 mol・L.-1 0.1 mol・L.-1 0.25 mol・L.-1
1×10-7 mol・L.-1 0.1 mol・L.-1 0.1b/a mol・L.-1 0.lb/(a+b) mol・L.-1
1mol・L-1甲酸溶液的c(H+)=10-2mol・L-1
甲酸以任意比与水互溶
10mL1mol・L-1的甲酸恰好与10mL
1mol・L-1的NaOH溶液完全反应
在相同条件下,甲酸溶液的导电能力比盐酸的弱
中和时所需NaOH的量
H+的物质的量
CH3COOH的物质的量
溶液的导电能力
用HR做导电实验,灯泡很暗
0.1mol・L-1HR溶液稀释到100倍时,溶液的pH为3.1
20mL0.1mol・L-1HR溶液恰好中和20mL0.1mol・L-1NaOH溶液
0.1mol・L-1NH4R溶液的pH等于7
一个化学反应是否能在常温下发生与该反应的△H.值的大小没有必然联系 中和热△H= - 57.3kJ・mol-1,所以1.00L 1.00mol・L-1H2SO4与稀的NaOH溶液恰好完全反应放出57.3kJ的热量
用等体积的0.50mol・L-1盐酸、0.55mol・L-1NaOH溶液进行中和热测定的实验,会使测得的值偏大
在101KPa时,1molCH4完全燃烧生成CO2和水蒸气放出的热量就是CH4的燃烧热
中和时所需NaOH的量 电离程度 H+的物质的量 CH3COOH的物质的量
0.001 mol/L的NaOH溶液pH=9 0.1 mol/L的H2SO4溶液pH=1 0.005 mol/L的H2SO4溶液与0.01 mol/L的NaOH溶液等体积混合,混合溶液pH为6,溶液显酸性 完全中和pH=3的H2SO4溶液50 mL,需要pH=11的NaOH溶液50 mL
1 mol・L-1甲酸溶液的c(H+)约为1×10-2 mol・L-1 甲酸能与水以任意比例混合 10 mL 1 mol・L-1甲酸恰好与10 mL 1 mol・L-1 NaOH溶液完全反应 在相同条件下,甲酸溶液的导电能力比硝酸溶液的弱
0. 05mol•L-1的H2SO4溶液,pH=l 0. 001mol•L-1的NaOH溶液,pH = 11 0. 005mol•L-1的H2SO4溶液与0.01mol•L-1的NaOH溶液等体积混合,混合溶液的pH为6,溶液显酸性 完全中和pH = 3的H2SO4溶液50 mL,需要pH = 11的NaOH溶液50 mL
该溶液中由水电离出的c(H.+)=1×10-3 mol・L-1 由pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中c(Na+)>c(A.-)>c(OH-)>c(H.+) 浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则c(A.-)>c(HA)>c(Na+)>c(H.+)>c(OH-) 0.1mol・L-1HA溶液与0.05mol・L-1NaOH溶液等体积混合后所得溶液中2c(H.+)+c(HA)=c(A.-)+2c(OH-)

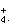 ]>[OH-]>[H+]
]>[OH-]>[H+]