你可能感兴趣的试题
已知C.(石墨,s)=C.(金刚石,s) △H.>0,则金刚石比石墨稳定 已知I2(g)+H2(g)=2HI(g) △H1;I2(s)+H2(g)=2HI(g) △H2; 则△H1<△H2 HCl和NaOH反应的中和热△H.=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H.=2×(-57.3)kJ/mol 已知H2(g)+F2(g)=2HF(g) △H.=-270kJ/mol,则2L氟化氢气体分解成1L氢气和1L氟气吸收270kJ热量
H0:H1: 若χ2 统计量很大, 则 P 便很小,说明和间差别很大。 若拒绝 H0 可认为和两两均不相等。 若χ 2 统计量非常小,则 P便较大,当时不拒绝 H0,也可能犯错误。 上述均不对
ΔE=2μH0, E=hυ0, ΔE=μβH0, υ0=2μβH0/h
已知c(石墨,s)=c(金刚石,s);△H.>0,则金刚石比石墨稳定 已知I2(g)+H2(g)=2HI(g),△H1; I2(s)+H2(g)=2HI(g),△H2; 则△H1<△H2 HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的 中和热△H=2×(-57.3)kJ/mol 已知H2(g)+F2(g)=2HF(g);△H=-270kJ/mol,则2L氟化氢气体分解成1L氢气和1L氟气吸收270kJ热量
2L氟化氢气体分解成1L氢气好1L氟气吸收270KJ 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270KJ
2L. HF气体分解成1L.的H2和1L.的F2吸收270 kJ热量 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 1个H2分子与1个F2分子反应生成2个HF分子放出270 kJ
温度:T1< T2 平衡常数:K(a)=K(b)反应速率:v(b)>v(a) 当 30g·mol-1时,n(HF):n[(HF)2]=2:1
30g·mol-1时,n(HF):n[(HF)2]=2:1 
氟化氢气体分解生成氢气和氟气的反应是放热反应 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 断裂1 mol H—H键和1 mol F—F 键放出的能量大于形成2 mol H—F键放出的能量
温度:T1< T2 平衡常数:K(a)=K(b)反应速率:v(b)>v(a)  当
当 30g·mol-1时,n(HF):n[(HF)2]=2:1
30g·mol-1时,n(HF):n[(HF)2]=2:1
在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ 该反应的逆反应是放热反应 该反应过程的能量变化可用右图来表示
在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和大于2 mol HF(g)的能量 1 mol H2(g)与1 mol F2(g)反应生成2 mol液态HF放出的热量小于270 kJ 该反应的逆反应是放热反应 该反应过程的能量变化可用右图来表示 
氟化氢气体分解生成氢气和氟气的反应是放热反应 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 断裂1 mol H—H键和1 mol F—F 键放出的能量大于形成2 mol H—F键放出的能量
氟化氢气体分解生成氢气和氟气的反应是放热反应 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 该反应中的能量变化可用如图来表示
建立假设时,有原假设H0和备择假设H1 已知μ0,可假设H0:μ=μ0;H1:μ≠μ0检验样本均值是否为μ0 正态总体σ0已知时,μ的显著性水平为α的检验采用 作为检验统计量 假设H0:μ≤μ0;H1:μ>μ0,是双侧假设检验。
作为检验统计量 假设H0:μ≤μ0;H1:μ>μ0,是双侧假设检验。
H2与F2反应的热化学方程式为:H2(g) + F2(g) = 2HF(g) △H.= -541 kJ 2 L. HF气体分解成1L. H2和1L. F2吸收541 kJ的热量 1 mol H2与1 mol F2反应生成2 mol液态HF放出热量小于541 kJ 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
2L氟化氢气体分解成1L氢气好1L氟气吸收270KJ 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270KJ
v(SiF4)消耗=4v(HF)生成 HF的体积分数不再变化
容器内气体压强不再变化 容器内气体的总质量不再变化
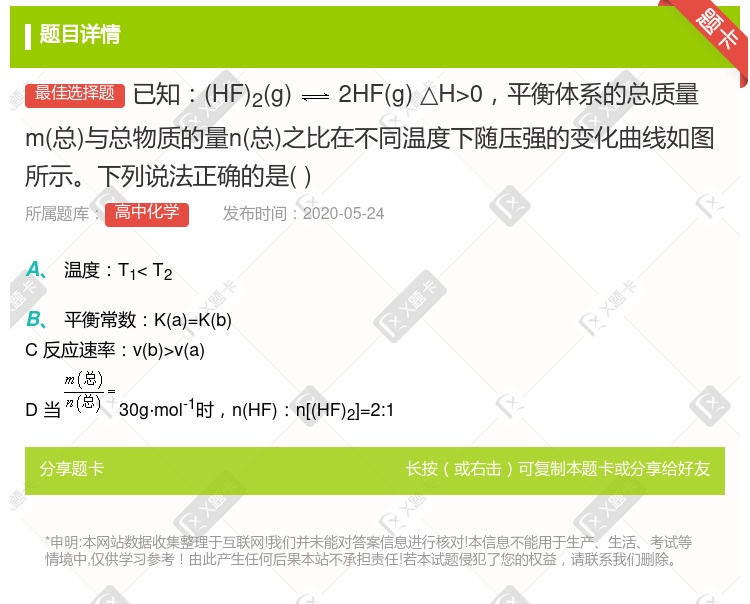
 30g·mol-1时,n(HF):n[(HF)2]=2:1
30g·mol-1时,n(HF):n[(HF)2]=2:1 
 当
当 30g·mol-1时,n(HF):n[(HF)2]=2:1
30g·mol-1时,n(HF):n[(HF)2]=2:1


 作为检验统计量 假设H0:μ≤μ0;H1:μ>μ0,是双侧假设检验。
作为检验统计量 假设H0:μ≤μ0;H1:μ>μ0,是双侧假设检验。