
 O2(g) ΔH.=-485 kJ·mol-1 H2O(g)===H2(g)+
O2(g) ΔH.=-485 kJ·mol-1 H2O(g)===H2(g)+ O2(g) ΔH.=+485 kJ·mol-1 2H2(g)+O2(g)===2H2O(g) ΔH.=+485 kJ·mol-1 2H2(g)+O2(g)===2H2O(g) ΔH.=-485 kJ·mol-1
O2(g) ΔH.=+485 kJ·mol-1 2H2(g)+O2(g)===2H2O(g) ΔH.=+485 kJ·mol-1 2H2(g)+O2(g)===2H2O(g) ΔH.=-485 kJ·mol-1
 O2(g) ΔH.=+242 kJ·mol-1 2H2(g)+O2(g)===2H2O(l) ΔH.=-484 kJ·mol-1 H2(g)+
O2(g) ΔH.=+242 kJ·mol-1 2H2(g)+O2(g)===2H2O(l) ΔH.=-484 kJ·mol-1 H2(g)+ O2(g)===H2O(g) ΔH.=+242 kJ·mol-1 2H2(g)+O2(g)===2H2O(g) ΔH.=+484 kJ·mol-1
O2(g)===H2O(g) ΔH.=+242 kJ·mol-1 2H2(g)+O2(g)===2H2O(g) ΔH.=+484 kJ·mol-1

 2H2O(g) ΔH.= -483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 已知NaOH(aq)+HCl(aq)
2H2O(g) ΔH.= -483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1 已知NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l) ΔH.=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 已知2C(s)+2O2(g)
NaCl(aq)+H2O(l) ΔH.=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 已知2C(s)+2O2(g) 2CO2(g) ΔH.=a 2C(s)+O2(g)
2CO2(g) ΔH.=a 2C(s)+O2(g) 2CO(g) ΔH.=b,则a>b 已知P(白磷,s)
2CO(g) ΔH.=b,则a>b 已知P(白磷,s) P(红磷,s) ΔH.<0,则白磷比红磷稳定
P(红磷,s) ΔH.<0,则白磷比红磷稳定
 O2(g) ΔH.=+242 kJ·mol-1 2H2(g)+O2(g)===2H2O(l) ΔH.=-484 kJ·mol-1 H2(g)+
O2(g) ΔH.=+242 kJ·mol-1 2H2(g)+O2(g)===2H2O(l) ΔH.=-484 kJ·mol-1 H2(g)+ O2(g)===H2O(g) ΔH.=+242 kJ·mol-1 2H2(g)+O2(g)===2H2O(g) ΔH.=+484 kJ·mol-1
O2(g)===H2O(g) ΔH.=+242 kJ·mol-1 2H2(g)+O2(g)===2H2O(g) ΔH.=+484 kJ·mol-1
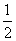 O2(g)===H2O(g) ΔH.=-242 kJ/mol H2(g)+
O2(g)===H2O(g) ΔH.=-242 kJ/mol H2(g)+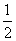 O2(g)===H2O(g) ΔH.=+242 kJ/mol 2H2(g)+O2(g)===2H2O(g) ΔH.=+484 kJ/mol
O2(g)===H2O(g) ΔH.=+242 kJ/mol 2H2(g)+O2(g)===2H2O(g) ΔH.=+484 kJ/mol
 O2(g)===H2O(g) ΔH.=-242 kJ/mol H2(g)+
O2(g)===H2O(g) ΔH.=-242 kJ/mol H2(g)+ O2(g)===H2O(g) ΔH.=+242 kJ/mol 2H2(g)+O2(g)===2H2O(g) ΔH.=+484 kJ/mol
O2(g)===H2O(g) ΔH.=+242 kJ/mol 2H2(g)+O2(g)===2H2O(g) ΔH.=+484 kJ/mol