
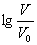 变化始终满足直线关系
变化始终满足直线关系 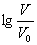 =3时,NaX溶液中所含离子总数小于NaY溶液 分别向稀释前的两种溶液加盐酸至pH=7时,c(X-)=c(Y-)
=3时,NaX溶液中所含离子总数小于NaY溶液 分别向稀释前的两种溶液加盐酸至pH=7时,c(X-)=c(Y-)
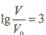 ,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则
,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则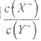 减小
减小
 浓度均为0.1 mol/L.的硫酸氢铵溶液和氢氧化钠溶液等体积混合
浓度均为0.1 mol/L.的硫酸氢铵溶液和氢氧化钠溶液等体积混合 浓度均为0.1 mol/L.的小苏打溶液和氢氧化钠溶液等体积混合
浓度均为0.1 mol/L.的小苏打溶液和氢氧化钠溶液等体积混合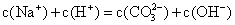 浓度均为0.1 mol/L.的醋酸溶液和氢氧化钠溶液等体积混合
浓度均为0.1 mol/L.的醋酸溶液和氢氧化钠溶液等体积混合 
 =3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则
=3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则 减小
减小
 =2时,若两溶液同时升高温度,则c(M+)/c(R+)增大
=2时,若两溶液同时升高温度,则c(M+)/c(R+)增大 
 时,若两溶液同时升高温度,则
时,若两溶液同时升高温度,则 增大
增大
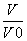 = 3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则
= 3,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则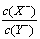 减小
减小
 变化始终满足直线关系
变化始终满足直线关系  =3时,NaX溶液中所含离子总数小于NaY溶液 分别向稀释前的两种溶液加盐酸至pH=7时,c(X-)=c(Y-)
=3时,NaX溶液中所含离子总数小于NaY溶液 分别向稀释前的两种溶液加盐酸至pH=7时,c(X-)=c(Y-)