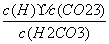你可能感兴趣的试题
在一定浓度下,平衡常数值越大则酸的电离度也越大 在一定浓度下,平衡常数值越大则酸的电离度越小 平衡常数值越大则溶液的浓度越大 平衡常数值越大则溶液的浓度越小
电离平衡常数受溶液浓度的影响 电离平衡常数可以表示弱电解质的相对强弱 电离常数大的酸溶液中c(H.+)一定比电离常数小的酸中大 H2CO3的电离常数表达式:K=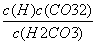
电离平衡常数受溶液浓度的影响 电离平衡常数可以表示弱电解质的相对强弱 电离常数大的酸溶液中c(H+)一定比电离常数小的酸中大 H2CO3的电离常数表达式:K= 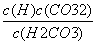
加水后,Y.酸的电离度增大 X.酸在水溶液中存在电离平衡 加水后,X.酸的电离平衡常数减小 X.酸的物质的量浓度与Y酸的物质的量浓度相等 
在18℃时溶解度比25℃时小 的电离是一个吸热过程 温度高时电离度变小 温度高时溶液中的氢离子浓度变小
在18℃时溶解度比25℃时小 的电离是一个放热过程 温度高时电离度变大 温度低时溶液中的氢氧根离子浓度变大
电离平衡常数可以表示弱电解质的相对强弱 电离平衡常数受溶液浓度的影响 H2CO3的电离常数表达式:K.= 电离常数大的酸溶液中c(H+)一定比电离常数小的酸中大
电离常数大的酸溶液中c(H+)一定比电离常数小的酸中大
该溶液中HA有0.1%发生了电离 此酸电离平衡常数约为10-7 升高温度后溶液的PH增大 若将PH=2的HA溶液与PH=12的NaOH溶液等体积混合后PH=7
在18℃时溶解度比25℃时小 的电离是一个放热过程 温度高时电离度变大 温度低时溶液中的氢离子浓度变大
该溶液中HA有0.1%发生了电离 此酸电离平衡常数约为10﹣7 升高温度后溶液的PH增大 若将PH=2的HA溶液与PH=12的NaOH溶液等体积混合后PH=7
在一定浓度下,平衡常数值越大则酸的电离度也越大 在一定浓度下,平衡常数值越大则酸的电离度越小 平衡常数值越大则溶液的浓度越大 平衡常数值越大则溶液的浓度越小
在18℃时溶解度比25℃时小 电离是一个放热过程 温度高时电离度变大 温度低时溶液中的氢离子浓度变大
在18℃时溶解度比25℃时小 的电离是一个吸热过程 温度高时电离度变小 温度高时溶液中的氢氧根离子浓度变小
在18℃时溶解度比25℃时小 的电离是一个吸热过程 温度高时电离度变大 温度高时溶液中的氢离子浓度变小
在18℃时溶解度比25℃时小 的电离是一个吸热过程 温度高时电离度变大 温度越低时溶液中的氢氧根离子浓度变得越大
平衡常数值越大则溶液的酸度越小 平衡常数值越大则溶液的酸度越大 平衡常数值越大则溶液的浓度越小 平衡常数值越大则溶液的浓度越大
电离平衡常数受溶液浓度的影响 电离平衡常数可以表示弱电解质的相对强弱 电离常数大的酸溶液中c(H+)一定比电离常数小的酸中大 H2CO3的电离常数表达式:K.=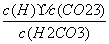
在18℃时溶解度比25℃小 的电离过程是放热过程 温度高时电离度变大 温度低时溶液中的氢离子浓度变大
HNO2的电离平衡常数是③ HNO2的电离平衡常数是① HCN的电离平衡常数是② HF的电离平衡常数是①

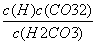
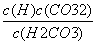

 电离常数大的酸溶液中c(H+)一定比电离常数小的酸中大
电离常数大的酸溶液中c(H+)一定比电离常数小的酸中大