你可能感兴趣的试题
MOH和ROH都是强碱 稀释前,c(ROH)=10c(MOH) 常温下pH之和为14的醋酸和ROH溶液等体积混合, 所得溶液呈碱性 在x点,c(M+)=c(R+)
在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变 将V1 mL④溶液与V2mL②溶液混合后,测得混合溶液pH=4,则V1:V2=9:11 分别加水稀释10倍,四种溶液的pH大小顺序为①〉②〉③〉④ 将①、④两种溶液等体积混合,所得溶液中•
两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol/L 分别加水稀释100倍后,两种溶液的pH仍相同ks5u 醋酸中的c(CH3COO-)和硫酸中的c(SO )相等 分别加入足量锌片,两种溶液生成H2的体积相同
)相等 分别加入足量锌片,两种溶液生成H2的体积相同
两种溶液中,由水电离出的氢氧根离子浓度均为1×10-11 mol·L.-1 分别加水稀释100倍后,两种溶液的pH仍相同 氨水中的c(NH4+)和氢氧化钡中的c(Ba2+):后者是前者的两倍 用等浓度盐酸分别中和体积相等的两种溶液,消耗盐酸的体积相同
稀释前,两种碱溶液中溶质的物质的量浓度一定相等 稀释后,X.溶液的碱性比Y.溶液的碱性强 完全中和X.、Y.溶液时,消耗同浓度盐酸的体积VX>VY 若8<a<10,则X.、Y.都是弱碱
MOH和ROH都是强碱 稀释前,[ROH]=10[MOH] 常温下pH之和为14的醋酸和ROH溶液等体积混合,所得溶液呈碱性 在x点,[M+]=[R+]
两种溶液中,由水电离出的氢离子浓度均为1×10-11mol·L-1 分别加水稀释100倍后,两种溶液的pH仍相同 醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等 分别加入足量锌片,两种溶液生成H2的体积相同
两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol/L 分别加水稀释100倍后,两种溶液的pH仍相同 醋酸中的c(CH3COO-)和硫酸中的c(SO )相等 分别加入足量锌片,两种溶液生成H2的体积相同
)相等 分别加入足量锌片,两种溶液生成H2的体积相同
两种溶液中,由水电离出的氢离子浓度均为l×10-11 mol·L-1
分别加水稀释100倍后,两种溶液的pH仍相等
中和同体积的这两种酸溶液所需要NaOH物质的量也相等
分别加入足量锌片,两种溶液生成H2的体积相等
两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol/L 分别加水稀释100倍后,两种溶液的pH仍相同 醋酸中的c(CH3COO-)和硫酸中的c(SO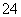 )相等 分别加入足量锌片,两种溶液生成H2的体积相同
)相等 分别加入足量锌片,两种溶液生成H2的体积相同
3种溶液pH的大小顺序是 ③>②>① 若将3种溶液稀释相同倍数,pH变化最大的是② 若分别加入25mL0.1mol·L-1盐酸后,pH最大的是① 若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
和 ,分别加水稀释至1000倍,其pH与所加水的体积变化如图所示,则下列结论中正确的是 ( ) A.A.酸比B.酸的电离程度小B.B.酸比A.酸容易电离 A.是强碱,B.是弱碱 pH=1时,B.酸的物质的量浓度比A.酸大
溶液中溶质的物质的量浓度:① > ② 溶液中酸根的物质的量浓度:① = ② 加水稀释至1L.,溶液的pH:① < ② 向其中分别加入质量、大小、形状完全相同的锌片,产生氢气的起始速率:① < ②
两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol•L-1 分别加水稀释100倍后,两种溶液的pH仍相同 醋酸溶液中的c(CH3COO-)和硫酸中的c(SO42-)相等 分别加入足量锌片,两种溶液生成H2的体积相同
两种溶液中,由水电离出的氢离子浓度均为l×10-11 mol·L-1
分别加水稀释100倍后,两种溶液的pH仍相等 中和同体积的这两种酸溶液所需要NaOH物质的量相等
分别加入足量锌片,两种溶液生成H2的体积相等
两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol·L-1 分别加水稀释100倍后,两种溶液的pH仍相同 醋酸中的c(CH3COO-)和硫酸中的c(SO )相等 分别加入足量锌片,两种溶液生成H2的体积相同
)相等 分别加入足量锌片,两种溶液生成H2的体积相同
两种溶液中的c(Na+)相等 两溶液中由水电离出的c(OH-)之比为10-9/10-5 分别加水稀释到100mL时,两种溶液的pH依然相等 分别与同浓度的盐酸反应,恰好反应时消耗的盐酸体积相等
稀释前,两种碱溶液中溶质的物质的量浓度一定相等 稀释后,X.溶液的碱性比Y.溶液的碱性强 完全中和X.、Y.溶液时,消耗同浓度盐酸的体积VX>VY 若8


 )相等 分别加入足量锌片,两种溶液生成H2的体积相同
)相等 分别加入足量锌片,两种溶液生成H2的体积相同
 )相等 分别加入足量锌片,两种溶液生成H2的体积相同
)相等 分别加入足量锌片,两种溶液生成H2的体积相同
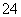 )相等 分别加入足量锌片,两种溶液生成H2的体积相同
)相等 分别加入足量锌片,两种溶液生成H2的体积相同

 )相等 分别加入足量锌片,两种溶液生成H2的体积相同
)相等 分别加入足量锌片,两种溶液生成H2的体积相同