你可能感兴趣的试题
[Mn]+[O]=(MnO) [Mn]+(1/2){O2}=(MnO) [Mn]+(FeO)=(MnO)+[Fe] 3[Mn]+(Cr2O3)=3(MnO)+2[Cr]
电池工作时,锌失去电子 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq) 电池工作时,电子由正极通过外电路流向负极 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
[Mn]+[O]=(MnO) [Mn]+(1/2){O<sub>2</sub>}=(MnO) [Mn]+(FeO)=(Mn)+[Fe]
电池工作时,锌失去电子 电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-===Mn2O3(s)+2OH-(aq) 电池工作时,电子由正极通过外电路流向负极 外电路中每通过0.1 mol电子,锌的质量理论上减小3.25 g
反应Ⅰ的离子方程式为MnO2+H2O2+2H+===Mn2++2H2O+O2↑ 反应Ⅱ中阴极反应式为Mn2+-2e-+2H2O===MnO2↓+4H+ 若加入KClO3,则反应Ⅲ为2ClO +5Mn2++4H2O===5MnO2↓+Cl2↑+8H+ 若加入KMnO4,则反应Ⅲ为3Mn2++2MnO
+5Mn2++4H2O===5MnO2↓+Cl2↑+8H+ 若加入KMnO4,则反应Ⅲ为3Mn2++2MnO +2H2O===5MnO2↓+4H+
+2H2O===5MnO2↓+4H+
Mn3O4→Mn2O3→MnO→Mn Mn3O4→Mn2O3→Mn MnO2→Mn2O3→Mn3O4→MnO→ 以上说法都正确
反应Ⅰ的离子方程式为MnO2+H2O2+2H+===Mn2++2H2O+O2↑ 反应Ⅱ中阴极反应式为Mn2+-2e-+2H2O===MnO2↓+4H+ 若加入KClO3,则反应Ⅲ为2ClO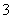 +5Mn2++4H2O===5MnO2↓+Cl2↑+8H+ 若加入KMnO4,则反应Ⅲ为3Mn2++2MnO
+5Mn2++4H2O===5MnO2↓+Cl2↑+8H+ 若加入KMnO4,则反应Ⅲ为3Mn2++2MnO +2H2O===5MnO2↓+4H+
+2H2O===5MnO2↓+4H+
[Mn]+[O]=(MnO) [Mn]+(1/2){O2}=(MnO) [Mn]+(FeO)=(Mn)十[Fe]

 +5Mn2++4H2O===5MnO2↓+Cl2↑+8H+ 若加入KMnO4,则反应Ⅲ为3Mn2++2MnO
+5Mn2++4H2O===5MnO2↓+Cl2↑+8H+ 若加入KMnO4,则反应Ⅲ为3Mn2++2MnO +2H2O===5MnO2↓+4H+
+2H2O===5MnO2↓+4H+
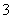 +5Mn2++4H2O===5MnO2↓+Cl2↑+8H+ 若加入KMnO4,则反应Ⅲ为3Mn2++2MnO
+5Mn2++4H2O===5MnO2↓+Cl2↑+8H+ 若加入KMnO4,则反应Ⅲ为3Mn2++2MnO +2H2O===5MnO2↓+4H+
+2H2O===5MnO2↓+4H+