你可能感兴趣的试题
氧化剂与还原剂的物质的量之比为2:1 氧化产物与还原产物的物质的量之比为1:2 反应中若有6molNO2参与反应,有4mol电子转移 反应中NO2是氧化剂,水是还原剂
根据物质能否溶于水,将物质分为易溶物质和难溶物质 根据化学反应中是否有单质生成把化学反应分为氧化还原反应和非氧化还原反应 根据物质中是否含碳元素,将物质分为无机物和有机物 根据酸中是否含有氧元素,将酸分为无氧酸和含氧酸
如果硝酸的量不足,则应该有Fe(NO3)2生成 上述反应配平后HNO3的化学计量数为10 若有0.1mol HNO3被还原,则生成2.24L NO气体 23.2g磁性氧化铁完全溶解于稀硝酸中,转移0.1mol电子
铜锌原电池,锌为正极 化学反应的反应热不仅与反应体系的始态和终态 有关,还与反应的途径有关 在氧化还原反应中,还原剂失去电子的总数等于氧化剂得到电子的总数 通过化学变化可以直接将水转变为汽油
水在化学反应中能做氧化剂 水既能与碱性氧化物反应,又能与酸性氧化物反应 水在化学反应中能做还原剂 过氧化钠与水反应时,每生成1molO2转移电子总数为2.408×1024
单质溶于水的过程中一定存在氧化还原反应 Na2O2是离子化合物,该物质中含有共价键 氧化还原反应中的反应物若不是氧化剂则必然是还原剂 在化学反应中,氧化剂中的各元素都一定被氧化
燃烧反应都是放热反应 对于可逆反应:aA(g)+bB(g)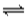 bC(g)+dD(g),如果正反应放热,逆反应一定吸热 氢气燃烧生成水是一个放热的化学反应,说明1 mol H2的能量高于1 mol H2O的能量 只有放热的氧化还原反应才可以设计为原电池
bC(g)+dD(g),如果正反应放热,逆反应一定吸热 氢气燃烧生成水是一个放热的化学反应,说明1 mol H2的能量高于1 mol H2O的能量 只有放热的氧化还原反应才可以设计为原电池
金属单质在化学反应中只能做还原剂 非金属单质在化学反应中只能做氧化剂 金属原子在化学反应中失去的电子越多,其还原性就越强 分解反应一定是氧化还原反应
配平后水的化学计量数为4 反应后溶液呈酸性 配平后氧化剂与还原剂的物质的量之比为3∶28 氧化产物为AsO43—和SO42—
凡是生成盐和水的反应都是中和反应 复分解反应一定是氧化还原反应 分解反应的生成物一定有单质 置换反应一定是氧化还原反应
燃烧反应都是放热反应 对于可逆反应:aA(g)+bB(g) bC(g)+dD(g),如果正反应放热,逆反应一定吸热 氢气燃烧生成水是一个放热的化学反应,说明1 mol H2的能量高于1 mol H2O的能量 只有放热的氧化还原反应才可以设计为原电池
bC(g)+dD(g),如果正反应放热,逆反应一定吸热 氢气燃烧生成水是一个放热的化学反应,说明1 mol H2的能量高于1 mol H2O的能量 只有放热的氧化还原反应才可以设计为原电池
IO4-作氧化剂 配平后Mn2+、H.+ 的化学计量数分别为2、3 氧化剂和还原剂的物质的量之比为5∶2 若有2mol Mn2+ 参加反应则转移10mol电子
硝化纤维、炸药等在无空气的环境中仍能迅速氧化的化学物质与强氧化剂 钾、钠、烷基铝、五氧化二磷等遇水发生危险化学反应的活泼金属和化学物质 遇水发生危险化学反应的化学物质 未封闭的带电设备

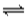 bC(g)+dD(g),如果正反应放热,逆反应一定吸热 氢气燃烧生成水是一个放热的化学反应,说明1 mol H2的能量高于1 mol H2O的能量 只有放热的氧化还原反应才可以设计为原电池
bC(g)+dD(g),如果正反应放热,逆反应一定吸热 氢气燃烧生成水是一个放热的化学反应,说明1 mol H2的能量高于1 mol H2O的能量 只有放热的氧化还原反应才可以设计为原电池
 bC(g)+dD(g),如果正反应放热,逆反应一定吸热 氢气燃烧生成水是一个放热的化学反应,说明1 mol H2的能量高于1 mol H2O的能量 只有放热的氧化还原反应才可以设计为原电池
bC(g)+dD(g),如果正反应放热,逆反应一定吸热 氢气燃烧生成水是一个放热的化学反应,说明1 mol H2的能量高于1 mol H2O的能量 只有放热的氧化还原反应才可以设计为原电池