你可能感兴趣的试题
Cl2的水溶液能导电,所以Cl2是电解质 0.01 mol/L的氨水可以使酚酞试液变红,说明氨水是弱电解质 在某温度下,测得纯水中c(H+)=2×10-7 mol/L,则c(OH-)为5×10-8mol/L 常温下0.1mol/L亚硝酸(HNO2)溶液的pH值为2.145,则亚硝酸是弱电解质
a点Kw =1.0×10-14 水的电离程度: b > c > a> d b点:C.(NH4+) >C.(Cl-) >C.(H+) >C.(OH-) 25℃时NH4Cl水解常数为(n-1)×10-7 mol•L-1
该滴定过程应该选择酚酞作为指示剂 M点对应的盐酸体积为20.0mL M点处的溶液中 N点处的溶液中pH<12
N点处的溶液中pH<12
向0.1 mol•L.-1CH3COOH溶液中加入少量水,溶液中减小 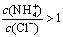 将CH3COONa溶液从20℃升温至60℃,溶液中减小 向盐酸中加入氨水至中性,溶液中 25℃时等体积等浓度的盐酸和氨水混合后,溶液的pH=7
将CH3COONa溶液从20℃升温至60℃,溶液中减小 向盐酸中加入氨水至中性,溶液中 25℃时等体积等浓度的盐酸和氨水混合后,溶液的pH=7
该滴定过程应该选择酚酞作为指示剂 M点对应的盐酸体积为20.0 mL M点处的溶液中c(N错误!未找到引用源。4+)=c(Cl-)=c(H+)=c(OH-) N点处的溶液中pH<12
为减小酸碱中和滴定的实验误差,锥形瓶必须洗净、烘干后使用 在氨水中加入少量的水或氯化铵固体后,都会使溶液中的c(H+)增大 已知NaAlO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为NaAlO2 由H+(aq)+OH-(aq)===H2O(l) ΔH.=-57.3 kJ·mol-1,可知100 mL 0.1 mol·L-1 的盐酸与100 mL 0.1 mol·L-1 的氨水混合,放出的热量等于0.573 kJ
氨水中的溶质是NH3 使氨水呈弱碱性的电解质是NH3・H2O 氨水中只存在五种微粒(分子或离子) C.(NH3) +C(NH )+C(NH3・H2O)=0.1 mol/L
)+C(NH3・H2O)=0.1 mol/L
含H+的溶液显酸性,含OH-的溶液显碱性 用丁达尔现象实验可区分葡萄糖溶液和氢氧化铁胶体 某饱和溶液变成不饱和溶液,溶质的质量分数一定减小 标准状况下,2.24L. NH3溶于水制得1L氨水,则c (NH3·H2O)=0.1mol·L-1
a点由水电离出的c(H+)=1.0×10-14mol·L-1 b点: c点:
c点: d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
室温下,a点的氨水电离常数为 mol·L-1 将此氨水稀释,溶液的导电能力减弱 c点时消耗盐酸体积V.(HCl)<20 mL a、d两点的溶液,水的离子积K.w(a)>K.w(d)
mol·L-1 将此氨水稀释,溶液的导电能力减弱 c点时消耗盐酸体积V.(HCl)<20 mL a、d两点的溶液,水的离子积K.w(a)>K.w(d)
向0.1 mol•L.-1CH3COOH溶液中加入少量水,溶液中减小 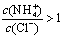 将CH3COONa溶液从20℃升温至60℃,溶液中减小 向盐酸中加入氨水至中性,溶液中 25℃时等体积等浓度的盐酸和氨水混合后,溶液的pH=7
将CH3COONa溶液从20℃升温至60℃,溶液中减小 向盐酸中加入氨水至中性,溶液中 25℃时等体积等浓度的盐酸和氨水混合后,溶液的pH=7
0.1 mol·L-1氨水,溶液的pH=13 0.1 mol·L-1氨水加水稀释,溶液中c(H+)和c(OH-)都减小 0.1 mol·L-1醋酸溶液中:c(H+)=c(CH3COO-) 0.1 mol·L-1醋酸与0.1 mol·L-1NaOH溶液等体积混合所得溶液中: c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
NH3·H2O为1mol ,溶质质量为35g NH4+为1mol ,溶质质量为18g 溶解状态的NH3分子为1mol,溶质质量为17g 氨水中NH3、NH3·H2O、NH4+三种微粒总的物质的量为1mol
该滴定过程应该选择酚酞作为指示剂 M点对应的盐酸体积为20.0mL M点处的溶液中 N点处的溶液中pH<12
N点处的溶液中pH<12
含H+的溶液显酸性,含OH—的溶液显碱性 用丁达尔现象实验可区分葡萄糖溶液和氢氧化铁胶体 某饱和溶液变成不饱和溶液,溶质的质量分数一定减小 标准状况2.24L. NH3溶于水制得1L氨水,则c(NH3·H2O)=0.1mol·L-1
向0.1 mol•L.-1CH3COOH溶液中加入少量水,溶液中减小 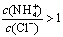 将CH3COONa溶液从20℃升温至60℃,溶液中减小 向盐酸中加入氨水至中性,溶液中 25℃时等体积等浓度的盐酸和氨水混合后,溶液的pH=7
将CH3COONa溶液从20℃升温至60℃,溶液中减小 向盐酸中加入氨水至中性,溶液中 25℃时等体积等浓度的盐酸和氨水混合后,溶液的pH=7
水的电离不受温度影响,只与溶液中酸或碱的浓度有关
在纯水中一定有c(H+)=c(OH-)=1×10-7mol/L
纯水是不能导电的,因为纯水不电离
氨水中水的电离程度小于纯水中水的电离程度
该滴定过程应该选择酚酞作为指示剂 M点对应的盐酸体积为20.0 mL M点处的溶液中c(NH )=c(Cl-)=c(H+)=c(OH-) N点处的溶液中pH<12
)=c(Cl-)=c(H+)=c(OH-) N点处的溶液中pH<12
O3的摩尔质量为48g/mol 物质的量的单位是克 1molCO在任何条件下的体积都为22.4L 将2molNaCl溶于1L水中,所得溶液的浓度为2mol·L—1
该滴定过程应该选择酚酞作为指示剂 M点对应的盐酸体积为20.0 mL M点处的溶液中c(N4+)=c(Cl-)=c(H+)=c(OH-) N点处的溶液中pH<12

 N点处的溶液中pH<12
N点处的溶液中pH<12
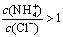 将CH3COONa溶液从20℃升温至60℃,溶液中减小 向盐酸中加入氨水至中性,溶液中 25℃时等体积等浓度的盐酸和氨水混合后,溶液的pH=7
将CH3COONa溶液从20℃升温至60℃,溶液中减小 向盐酸中加入氨水至中性,溶液中 25℃时等体积等浓度的盐酸和氨水混合后,溶液的pH=7
 )+C(NH3・H2O)=0.1 mol/L
)+C(NH3・H2O)=0.1 mol/L
 c点:
c点: d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
 mol·L-1 将此氨水稀释,溶液的导电能力减弱 c点时消耗盐酸体积V.(HCl)<20 mL a、d两点的溶液,水的离子积K.w(a)>K.w(d)
mol·L-1 将此氨水稀释,溶液的导电能力减弱 c点时消耗盐酸体积V.(HCl)<20 mL a、d两点的溶液,水的离子积K.w(a)>K.w(d)
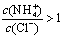 将CH3COONa溶液从20℃升温至60℃,溶液中减小 向盐酸中加入氨水至中性,溶液中 25℃时等体积等浓度的盐酸和氨水混合后,溶液的pH=7
将CH3COONa溶液从20℃升温至60℃,溶液中减小 向盐酸中加入氨水至中性,溶液中 25℃时等体积等浓度的盐酸和氨水混合后,溶液的pH=7
 N点处的溶液中pH<12
N点处的溶液中pH<12
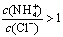 将CH3COONa溶液从20℃升温至60℃,溶液中减小 向盐酸中加入氨水至中性,溶液中 25℃时等体积等浓度的盐酸和氨水混合后,溶液的pH=7
将CH3COONa溶液从20℃升温至60℃,溶液中减小 向盐酸中加入氨水至中性,溶液中 25℃时等体积等浓度的盐酸和氨水混合后,溶液的pH=7
 )=c(Cl-)=c(H+)=c(OH-) N点处的溶液中pH<12
)=c(Cl-)=c(H+)=c(OH-) N点处的溶液中pH<12