你可能感兴趣的试题
0.1mol・L-1NaHCO3溶液中离子浓度间的关系:[Na+]=2[ ]+[
]+[ ]+[H2CO3]
]+[H2CO3]
0.1mol・L-1NH4Cl溶液和0.1mol・L-1NH3・H2O溶液等体积混合后离子浓度间的关系:[Cl-]> >[H+]>[OH-]
>[H+]>[OH-]
常温下,向醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中:[Na+]=[CH3COO-]
常温下,在pH=1的溶液中Fe2+、 、ClO-、Na+能大量共存
、ClO-、Na+能大量共存
1mol氖气中含有的原子数目为NA 5.85 g NaCl中含有的最外层电子数目为1.6NA 2 mol NO和1 mol O2混合,充分反应后转移的电子数目为4NA 25℃时,1L0. 1 mo1• L-1 Na2S溶液中的阴离子数目小于0.1 NA
1.0 mol・L-1 Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) 1.0 mol・L-1NH4Cl溶液:c(NH4+)<c(Cl-) 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-)
10mL0.1mol・L-1氨水与10mL0.1mol・L-1盐酸混合:[Cl-]>[NH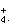 ]>[OH-]>[H+]
]>[OH-]>[H+]
10mL0.1mol・L-1NH4Cl溶液与5mL0.2mol・L-1NaOH溶液混合:[Na+]=[Cl-]>[OH-]>[H+]
10mL0.1mol・L-1CH3COOH溶液与5mL0.2mol・L-1NaOH溶液混合:[Na+]=[CH3COO-]>[OH-]>[H+]
10mL0.5mol・L-1CH3COONa溶液与6mL1mol・L-1盐酸混合:[Cl-]>[Na+]>[OH-]>[H+]
2L溶液中的阴、阳离子总数为0.8NA
500 mL溶液中 浓度为0.2 mol・L-1
浓度为0.2 mol・L-1
500 mL溶液中Ba2+浓度为0.2 mol・L-1
500 mL溶液中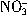 总数为0.2 NA
总数为0.2 NA
0.1mol・L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) 0.1mol・L-1CH3COONa溶液中:c(Na+)=c(CH3COO-)+c(OH-) 浓度均为0.1mol・L-1的CH3COONa、NaOH和Na2CO3三种溶液的pH大小顺序: pH(NaOH)>pH(Na2CO3)>pH(CH3COONa) 向0.1mol・L-1CH3COOH溶液中滴加NaOH溶液至中性,溶液中离子浓度的关系: c(CH3COO-)>c(Na+)>c(OH-)=c(H+)
c(Na+)=c(HB-)+2c(B2-)+c(OH-)
c(Na+)=0.1mol・L-1≥c(B2-)
c(H+)・c(OH-)=1.0×10-14
溶液的pH=1
液面在“0”刻度时,50 mL滴定管和25 mL滴定管所盛溶液的体积 在反应2H2S+SO2=3S↓+2H2O中氧化产物与还原产物的质量 相同温度下,0.6 mol・L-1醋酸溶液与0.3 mol・L-1醋酸溶液中的c(H+) 在Na2S溶液中,c(Na+)与c(S2-)
0.1 mol/LCH3COOH溶液中:c(CH3COO-)+ c(CH3COOH)=0.1mol/L NaHCO3溶液中: c(OH-) = c(H+) + c(H2CO3)-c(CO32-) CH3COONa溶液中:c(Na+)> c(CH3COO-)> c(OH-)> c(H+) Na2S溶液中:2 c(Na+)= c(S2-) + c(HS-)+ c(H2S)
c(Na+)+c(H+)=2c(S2-)+c(OH-)+c(HS-) c(Na+)>c(S2-)>c(HS-)>c(HS-)>c(OH-)>c(H+) c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+) c(S2-)+c(HS-)+c(H2S)=1.0mol・L-1
混合液中:c(Na+) = c(CH3COO-) 原醋酸的物质的量浓度大于0.01 mol ・ L 1 原醋酸中c(H+)小于0.01 mol ・ L 1 混合液中:c(CH3COOH) + c(CH3COO-) = 0.005 mol ・ L 1
该溶液的物质的量浓度为1mol・L.-1 该溶液中含有58.5g NaC1 配制100mL该溶液需用58.5g NaC1 量取100mL该溶液倒入烧末中,烧杯中C.1-的物质的量为0.1mol
三种离子对应的硫化物中Ksp(CuS)最小,约为1×10-20 可用MnS除去MnCl2溶液中混有的少量杂质ZnCl2 向MnS的悬浊液中加入少量水,沉淀溶解平衡向溶解的方向移动,c(S2-)增大 向浓度均为1×10-5 mol·L-1的Cu2+、Zn2+、Mn2+混合溶液中逐滴加入l×l0-4 mol·L-1的Na2S溶液,Zn2+最先沉淀
因为A2-+H2O  HA-+OH-,所以Na2A溶液显碱性 0.1mol・L-1 H2A溶液中氢离子的物质的量浓度为0.11 mol・L-1 NaHA溶液中各种离子浓度的关系是c(Na+)>c(HA-)>c(H+)>c(A2-)> c(OH-) 在NaHA溶液中,HA-电离的趋势大于其水解的趋势
HA-+OH-,所以Na2A溶液显碱性 0.1mol・L-1 H2A溶液中氢离子的物质的量浓度为0.11 mol・L-1 NaHA溶液中各种离子浓度的关系是c(Na+)>c(HA-)>c(H+)>c(A2-)> c(OH-) 在NaHA溶液中,HA-电离的趋势大于其水解的趋势
0.1mol・L.―1 HCOOH溶液中:c(HCOO―)+c(OH―)=c(H+) 1L 0.1mol・L.―1 CuSO4・(NH4)2SO4・6H2O的溶液中: c(SO42―)>c(NH4+)>c(Cu2+)>c(H+)>c(OH―) 0.1mol・L.―1 NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3―)+c(CO32―)+c(OH―) 等体积、等物体的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X.―)>c(H+)>(OH―)
同温度下,CuS的溶解度大于FeS的溶解度 同温度下,向饱和FeS溶液中加入少量Na2S固体后,Ksp(FeS)变小 向含有等物质的量的FeCl2和CuCl2的混合溶液中逐滴加入Na2S溶液,最先出现的沉淀是FeS 除去工业废水中的Cu2+,可以选用FeS作沉淀剂
2L溶液中阴、阳离子的总数为1.2NA 500mL溶液中NO3-的浓度为0.2 mol・L -1 500mL溶液中Ba2+的浓度为0.2 mol・L -1 500mL溶液中NO3-的总数为0.2NA
2L溶液中的阴、阳离子总数为0.8NA
500mL溶液中 浓度为0.4mol・L-1
浓度为0.4mol・L-1
500mL溶液中Ba2+浓度为0.2mol・L-1
500mL溶液中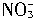 总数为0.2NA
总数为0.2NA
c(H2S)+c(HS-)+c(S2-)=0.1 c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) c(OH-)=c(H+)+ c(HS-)+2c(H2S) c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)

 ]+[
]+[ ]+[H2CO3]
]+[H2CO3] >[H+]>[OH-]
>[H+]>[OH-] 、ClO-、Na+能大量共存
、ClO-、Na+能大量共存
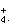 ]>[OH-]>[H+]
]>[OH-]>[H+] 浓度为0.2 mol・L-1
浓度为0.2 mol・L-1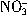 总数为0.2 NA
总数为0.2 NA
 HA-+OH-,所以Na2A溶液显碱性 0.1mol・L-1 H2A溶液中氢离子的物质的量浓度为0.11 mol・L-1 NaHA溶液中各种离子浓度的关系是c(Na+)>c(HA-)>c(H+)>c(A2-)> c(OH-) 在NaHA溶液中,HA-电离的趋势大于其水解的趋势
HA-+OH-,所以Na2A溶液显碱性 0.1mol・L-1 H2A溶液中氢离子的物质的量浓度为0.11 mol・L-1 NaHA溶液中各种离子浓度的关系是c(Na+)>c(HA-)>c(H+)>c(A2-)> c(OH-) 在NaHA溶液中,HA-电离的趋势大于其水解的趋势
 浓度为0.4mol・L-1
浓度为0.4mol・L-1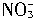 总数为0.2NA
总数为0.2NA