你可能感兴趣的试题
N2的量越多,H2 的转化率越大,因此,充入的N2越多越有利于NH3的合成 恒容条件下充入稀有气体有利于NH3 的合成 工业合成氨的反应是熵增加的放热反应,在任何温度下都可自发进行 工业合成氨的反应是熵减小的放热反应,在常温时可自发进行
在动力、设备、材料允许的情况下,反应尽可能在__下进行 温度越高越有利于工业合成氨 在工业合成氨中N2、H2的循环利用可提高其利用率,降低成本 及时从反应体系中分离出氨气有利于平衡向正反应方向移动
c点处正反应速率和逆反应速率相等 a点处正反应速率比b点处的大 d点(t1时刻)和e点(t2时刻)处n(N2)不同 t2时刻,正反应速率大于逆反应速率 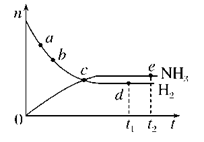
c点处正反应速率和逆反应速率相等 a点处正反应速率比b点处的大 d点(t1时刻)和e点(t2时刻)处n(N2)不同 t2点时刻,正反应速率大于逆反应速率
反应物和生成物的浓度相等 N2和H2的浓度之比一定为1:3 降低温度,平衡混合物里NH3的浓度增大 增大压强,不利于氨的合成
v(H2)=v(N2)= v(NH3) v(H2)=3 v(N2) v(N2)=2 v(NH3) v(NH3)=3/2v(H2)
该反应使用铁触媒作催化剂,目的是为了增大反应速率,同时提高产率 升高温度可以增大正反应速率,同时减小逆反应速率 达到平衡时,N2、H2、NH3的浓度之比为1∶3∶2 为了提高H2的转化率,可适当提高N2的浓度
从合成塔出来的混合气体,NH3的含量较小,所以生产氨的工厂的效率都很低 由于氨可液化分离出来,N2、H2在实际生产中循环使用,所以总体来说氨的产率很高 合成氨工业的反应温度控制在500 ℃,目的是使化学平衡向正反应方向移动 合成氨厂采用的压强是20 MPa~50 MPa,因在该压强下铁触媒的活性最大
c点处正反应速率和逆反应速率相等 a点处正反应速率比b点处的大 d点(t1时刻)和e点(t2时刻)处n(N2)不同 t2时刻,正反应速率大于逆反应速率
点c处正反应速率和逆反应速率相等 点a的正反应速率比点b的大 点d (t1时刻) 和点 e (t2时刻) 处n(N2)不同 在t2时刻,正反应速率大于逆反应速率
v(H2)=v(N2)=v (NH3) 3v(H2)=v(N2) v(NH3)= v(H2) v(H2)=3v(N2)
v(H2) v(H2)=3v(N2)
v(H2)=v(N2)=v(NH3) 3v(H2)=v(N2) v(NH3)= v(H2) v(H2)=3v(N2)
v(H2) v(H2)=3v(N2)
c点处正反应速率和逆反应速率相等 用同一物质表示,a点处正反应速率比b点处 的大 d点(t1时刻)和e点(t2时刻)处n(N2)不同 t2时刻,正反应速率大于逆反应速率
2NO2  N2O4 (正反应为放热反应) C.(s)+ CO2
N2O4 (正反应为放热反应) C.(s)+ CO2  2CO (正反应为吸热反应) N2 + 3H2
2CO (正反应为吸热反应) N2 + 3H2  2NH3 (正反应为放热反应) H2S
2NH3 (正反应为放热反应) H2S  H2 +S.(s)(正反应为吸热反应)
H2 +S.(s)(正反应为吸热反应)
c点处正反应速率和逆反应速率相等 a点处正反应速率比b点处的大 d点(t1时刻)和e点(t2时刻)处n(N2)不同 t2时刻,正反应速率大于逆反应速率 


 v(H2) v(H2)=3v(N2)
v(H2) v(H2)=3v(N2)
 v(H2) v(H2)=3v(N2)
v(H2) v(H2)=3v(N2)
 N2O4 (正反应为放热反应) C.(s)+ CO2
N2O4 (正反应为放热反应) C.(s)+ CO2  2CO (正反应为吸热反应) N2 + 3H2
2CO (正反应为吸热反应) N2 + 3H2  2NH3 (正反应为放热反应) H2S
2NH3 (正反应为放热反应) H2S  H2 +S.(s)(正反应为吸热反应)
H2 +S.(s)(正反应为吸热反应)
