你可能感兴趣的试题
71g该氯气样品含1摩尔氯气 22.4L该氯气样品质量是74g 37.g该氯气样品与足量NaOH完全反应生成Na37Cl和Na37Cl03,氧化剂和还原剂 的质量之比为5:1 0.l摩尔氯气分子溶于水形成l000mL溶液,溶液中c(Cl-)+ c(ClO-)=0.lmol/L.
所得氯气的相对分子质量约为71 KCl中只含35Cl 所得的KCl中既含35Cl又含37Cl 被氧化和被还原的氯原子数之比为5:1
KCl中含有35Cl 生成物Cl2的相对分子质量为73.3 该反应转移的电子数为6e- 氧化剂和还原剂的物质的量之比为1:6
氯化钾既不是氧化产物,也不是还原产物 被还原的K35ClO3和被氧化的H37Cl的物质的量之比为1∶6 生成氯气的相对分子质量为72 每生成标准状况下的氯气11.2L,转移电子数为6.02×1023
代表阿伏伽德罗常数的值。K35ClO3与H37Cl反应后生成氯气、氯化钾和水。下列说法正确的是 A.生成氯气的相对分子质量为71 生成1 mol氯化钾转移5 N.A个电子 生成氯化钾的摩尔质量为76 g/mol 1molH37Cl参加反应转移N.A.个电子
苛性钾溶液中KOH的物质的量是0.09mol ClO3-的生成是由于氯气的量的多少引起的 在酸性条件下ClO-和ClO3-可生成Cl2 反应中转移电子的物质的量是0.21mol
KCl中含有35Cl KCl中含有37Cl 生成物Cl2的相对分子质量大于71 该反应转移的电子数为6e-
Cl2相对分子质量约为73.3 该反应转移电子数为6 KCl中只含有35Cl KCl中同时含有35Cl和37Cl
钢铁腐蚀时可能发生的正极反应:2H2O + O2 + 4e- = 4OH- 向KHSO4溶液中滴入Ba(OH)2溶液使pH=7: SO42- + 2 H+ + Ba2+ + 2OH-= BaSO4↓+ 2 H2O 明矾水解的离子方程式:Al3+ + 3H2O 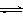 Al(OH)3 + 3H+ K37ClO3与浓盐酸(HCl)在加热时生成氯气:K37ClO3 + 6HClΔ K37Cl + 3Cl2↑+ 3H2O
Al(OH)3 + 3H+ K37ClO3与浓盐酸(HCl)在加热时生成氯气:K37ClO3 + 6HClΔ K37Cl + 3Cl2↑+ 3H2O
苛性钾溶液中KOH的物质的量是0.09mol 反应中转移电子的物质的量是0.21mol 在酸性条件下ClO-和ClO3-可生成Cl2 ClO3-的生成是由于氯气的量的多少引起的
该反应中电子转移数为6 KCl中只含35Cl KCl中既有35Cl,又有37Cl 生成的氯气式量约为73.3

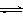 Al(OH)3 + 3H+ K37ClO3与浓盐酸(HCl)在加热时生成氯气:K37ClO3 + 6HClΔ K37Cl + 3Cl2↑+ 3H2O
Al(OH)3 + 3H+ K37ClO3与浓盐酸(HCl)在加热时生成氯气:K37ClO3 + 6HClΔ K37Cl + 3Cl2↑+ 3H2O