
 N. t2时,正逆反应速率相等,达到平衡 t3时,正反应速率大于逆反应速率 t1时,N.的浓度是M.浓度的2倍
N. t2时,正逆反应速率相等,达到平衡 t3时,正反应速率大于逆反应速率 t1时,N.的浓度是M.浓度的2倍
 N t1时,N.的物质的量浓度是M.物质的量浓度的2倍 t2时,正逆反应速率相等,达到平衡 t3时,正反应速率大于逆反应速率
N t1时,N.的物质的量浓度是M.物质的量浓度的2倍 t2时,正逆反应速率相等,达到平衡 t3时,正反应速率大于逆反应速率
 2M t2时,正、逆反应速率相等,达到平衡 t3时,正反应速率大于逆反应速率 t1时N的浓度是M.浓度的2倍
2M t2时,正、逆反应速率相等,达到平衡 t3时,正反应速率大于逆反应速率 t1时N的浓度是M.浓度的2倍 
 N t2时,正逆反应速率相等,达到平衡 t3时,正反应速率大于逆反应速率 t1时,N.的浓度是M.浓度的2倍
N t2时,正逆反应速率相等,达到平衡 t3时,正反应速率大于逆反应速率 t1时,N.的浓度是M.浓度的2倍
 N t1时,正、逆反应速率相等,达平衡 t3时,正反应速率大于逆反应速率 t1时,N.的浓度是M.浓度的2倍
N t1时,正、逆反应速率相等,达平衡 t3时,正反应速率大于逆反应速率 t1时,N.的浓度是M.浓度的2倍 
 2M t1时N.的浓度是M.浓度的4倍
2M t1时N.的浓度是M.浓度的4倍
 N t1时,N.的物质的量浓度是M.物质的量浓度的2倍 t2时,正逆反应速率相等,达到平衡 t3时,正反应速率大于逆反应速率
N t1时,N.的物质的量浓度是M.物质的量浓度的2倍 t2时,正逆反应速率相等,达到平衡 t3时,正反应速率大于逆反应速率
 N t3时,正逆反应速率相等 t2时,N.的消耗速率大于N.的生成速率 t1时,N.的浓度是M.浓度的2倍
N t3时,正逆反应速率相等 t2时,N.的消耗速率大于N.的生成速率 t1时,N.的浓度是M.浓度的2倍
 N t2时,正逆反应速率相等,达到平衡 t3时,正反应速率大于逆反应速率 t1时,N.的浓度是M.浓度的2倍
N t2时,正逆反应速率相等,达到平衡 t3时,正反应速率大于逆反应速率 t1时,N.的浓度是M.浓度的2倍 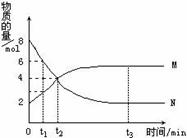
 N t2时,正、逆反应速率相等,达到平衡 t3时,正反应速率大于逆反应速率 t1时N.的浓度是M.浓度的2倍
N t2时,正、逆反应速率相等,达到平衡 t3时,正反应速率大于逆反应速率 t1时N.的浓度是M.浓度的2倍
 N t2时,正逆反应速率相等,达到平衡 t3时,正反应速率大于逆反应速率 t1时,N.的浓度是M.浓度的2倍
N t2时,正逆反应速率相等,达到平衡 t3时,正反应速率大于逆反应速率 t1时,N.的浓度是M.浓度的2倍
 N t2时,正逆反应速率相等,达到平衡 t3时,正反应速率大于逆反应速率 t1时,N.的浓度是M.浓度的2倍
N t2时,正逆反应速率相等,达到平衡 t3时,正反应速率大于逆反应速率 t1时,N.的浓度是M.浓度的2倍
 2M t2时,反应不再发生 t2时,正反应速率等于逆反应速率 t3后,反应到达最大限度
2M t2时,反应不再发生 t2时,正反应速率等于逆反应速率 t3后,反应到达最大限度 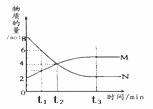
 N t1时,N.的物质的量浓度是M.物质的量浓度的2倍 t2时,正逆反应速率相等,达到平衡 t3时,正反应速率大于逆反应速率
N t1时,N.的物质的量浓度是M.物质的量浓度的2倍 t2时,正逆反应速率相等,达到平衡 t3时,正反应速率大于逆反应速率
 N t2时,正逆反应速率相等,达到平衡 t3时,逆反应速率大于正反应速率 t1时,N.的浓度是M.浓度的2倍
N t2时,正逆反应速率相等,达到平衡 t3时,逆反应速率大于正反应速率 t1时,N.的浓度是M.浓度的2倍 