
 2C(g);△H<0。若起始时,M.、N.容积相同。下列说法正确的是( ) A.起始时,分别向M.、N.两个容器中加入1molA.1molB,达平衡时,容器M.、N.中物质A.的体积分数相同 起始时,分别向M.、N.两个容器中加入1molA.3molB,达平衡时,容器M.中物质A.的转化率较大 起始时,分别向M.、N.两个容器中加入2molC,容器N.达到平衡所需的时间较短 起始时,分别向M.、N.两个容器中加入1molA.3molB,达到平衡时,容器M.中气体的密度较大
2C(g);△H<0。若起始时,M.、N.容积相同。下列说法正确的是( ) A.起始时,分别向M.、N.两个容器中加入1molA.1molB,达平衡时,容器M.、N.中物质A.的体积分数相同 起始时,分别向M.、N.两个容器中加入1molA.3molB,达平衡时,容器M.中物质A.的转化率较大 起始时,分别向M.、N.两个容器中加入2molC,容器N.达到平衡所需的时间较短 起始时,分别向M.、N.两个容器中加入1molA.3molB,达到平衡时,容器M.中气体的密度较大
 2C(g) ΔH.=-192 kJ·mol-1。向M.、N.中,都通入x molA.和y mol 的混合气体,初始M.、N.容积相同,保持温度不变。下列说法正确的是
2C(g) ΔH.=-192 kJ·mol-1。向M.、N.中,都通入x molA.和y mol 的混合气体,初始M.、N.容积相同,保持温度不变。下列说法正确的是  A.平衡时A.气体在两容器中体积分数可能相等 B.若x:y=1:2,则平衡时,M.中的转化率:A.>B. 若x:y=1:3,当M.中放出热量172.8 kJ时,A.的转化率为90% 若x=1, y=3,则达到平衡时反应物的转化率N>M
A.平衡时A.气体在两容器中体积分数可能相等 B.若x:y=1:2,则平衡时,M.中的转化率:A.>B. 若x:y=1:3,当M.中放出热量172.8 kJ时,A.的转化率为90% 若x=1, y=3,则达到平衡时反应物的转化率N>M
若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
若x<3,C的平衡浓度关系为:c(M)>c(N)
x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中AB的浓度均相等
 2C(g) ΔH.=-192 kJ·mol-1。向M.、N.中,都通入x molA.和y mol 的混合气体,初始M.、N.容积相同,保持温度不变。下列说法正确的是
2C(g) ΔH.=-192 kJ·mol-1。向M.、N.中,都通入x molA.和y mol 的混合气体,初始M.、N.容积相同,保持温度不变。下列说法正确的是  A.平衡时A.气体在两容器中体积分数可能相等 B.若x:y=1:2,则平衡时,M.中的转化率:A.>B. 若x:y=1:3,当M.中放出热量172.8 kJ时,A.的转化率为90% 若x=1, y=3,则达到平衡时反应物的转化率N>M
A.平衡时A.气体在两容器中体积分数可能相等 B.若x:y=1:2,则平衡时,M.中的转化率:A.>B. 若x:y=1:3,当M.中放出热量172.8 kJ时,A.的转化率为90% 若x=1, y=3,则达到平衡时反应物的转化率N>M
 2C(g) ΔH.=-192 kJ·mol-1。向M.、N.中,都通入x molA.和y mol 的混合气体,初始M.、N.容积相同,保持温度不变。下列说法正确的是 ( ) A.若平衡时A.气体在两容器中的体积分数相等,则x一定等于y B.若x:y=1∶2,则平衡时,M.中的转化率:A.>B 若x:y=1∶3,当M.中放出热量172.8 kJ时,A.的转化率为90% 若x=1.2,y=1,N.中达到平衡时体积为2L.,含有C 0.4 mol,再通入0.36 molA.时,v正>v逆
2C(g) ΔH.=-192 kJ·mol-1。向M.、N.中,都通入x molA.和y mol 的混合气体,初始M.、N.容积相同,保持温度不变。下列说法正确的是 ( ) A.若平衡时A.气体在两容器中的体积分数相等,则x一定等于y B.若x:y=1∶2,则平衡时,M.中的转化率:A.>B 若x:y=1∶3,当M.中放出热量172.8 kJ时,A.的转化率为90% 若x=1.2,y=1,N.中达到平衡时体积为2L.,含有C 0.4 mol,再通入0.36 molA.时,v正>v逆
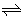 xC(g),向M.、N.中通入1molA和2molB的混合气体,初始M、N.容积相同,保持温度不变。下列说法正确的是( )
xC(g),向M.、N.中通入1molA和2molB的混合气体,初始M、N.容积相同,保持温度不变。下列说法正确的是( )  A.若x=3,达到平衡后A.的体积分数关系为:
A.若x=3,达到平衡后A.的体积分数关系为: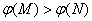 若x<3, 的平衡浓度关系为:c(M)
若x<3, 的平衡浓度关系为:c(M)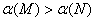

 2C(g);正反应放热。若起始时,M.、N.容积相同。下列说法正确的是( )A.起始时,分别向M.、N.两个容器中加入1molA.1molB,达平衡时,容器M.、N.中物质A.的体积分数相同 起始时,分别向M.、N.两个容器中加入1molA.3molB,达平衡时,容器M.中物质A.的转化率较大 起始时,分别向M.、N.两个容器中加入2molC,容器N.达到平衡所需的时间较短 起始时,分别向M.、N.两个容器中加入1molA.3molB,达到平衡时,容器M.中气体的密度较大
2C(g);正反应放热。若起始时,M.、N.容积相同。下列说法正确的是( )A.起始时,分别向M.、N.两个容器中加入1molA.1molB,达平衡时,容器M.、N.中物质A.的体积分数相同 起始时,分别向M.、N.两个容器中加入1molA.3molB,达平衡时,容器M.中物质A.的转化率较大 起始时,分别向M.、N.两个容器中加入2molC,容器N.达到平衡所需的时间较短 起始时,分别向M.、N.两个容器中加入1molA.3molB,达到平衡时,容器M.中气体的密度较大
 xC(g)ΔH=-192kJ·mol-1。向M.、N.中都通入1molA和2molB的混合气体,初始M.、N.容积相同,保持温度不变。下列说法正确的是 A.若x=3,达到平衡后A.的体积分数关系为:φ(M.)>φ(N.) 若x>3,达到平衡后B.的转化率关系为:α(M.)>α(N) 若x<3,C.的平衡浓度关系为:c(M.)>c(N.) x不论为何值,起始时向N.容器中充入任意值的C.,平衡后N.容器中A.的浓度均相等
xC(g)ΔH=-192kJ·mol-1。向M.、N.中都通入1molA和2molB的混合气体,初始M.、N.容积相同,保持温度不变。下列说法正确的是 A.若x=3,达到平衡后A.的体积分数关系为:φ(M.)>φ(N.) 若x>3,达到平衡后B.的转化率关系为:α(M.)>α(N) 若x<3,C.的平衡浓度关系为:c(M.)>c(N.) x不论为何值,起始时向N.容器中充入任意值的C.,平衡后N.容器中A.的浓度均相等
若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
若x<3,C的平衡浓度关系为:c(M)>c(N)
x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中AB的浓度均相等




 xC(g)△H=﹣192kJ•mol﹣1,向M.、N.中都通入1molA.和2mol 的混合气体,初始M.、N.容积相同,保持温度不变.下列说法正确的是( ) A.若x=3,达到平衡后A.的体积分数关系为:φ(M.)>φ(N.) B.若x>3,达到平衡后B.的转化率关系为:α(M.)>α(N.) 若x<3,C.的平衡浓度关系为:c(M.)>c(N.) x不论为何值,起始时向N.容器中充入任意值的C.,平衡后N.容器中A.的浓度均相等
xC(g)△H=﹣192kJ•mol﹣1,向M.、N.中都通入1molA.和2mol 的混合气体,初始M.、N.容积相同,保持温度不变.下列说法正确的是( ) A.若x=3,达到平衡后A.的体积分数关系为:φ(M.)>φ(N.) B.若x>3,达到平衡后B.的转化率关系为:α(M.)>α(N.) 若x<3,C.的平衡浓度关系为:c(M.)>c(N.) x不论为何值,起始时向N.容器中充入任意值的C.,平衡后N.容器中A.的浓度均相等