你可能感兴趣的试题
它是一种容量分析方法 它既是容量分析方法,又是电化学分析方法 它不是容量分析方法,是电化学分析方法 它是根据滴定剂消耗的体积来确定待测组分含量的
电流方向:电极Ⅳ→Ⓐ→电极Ⅰ 电极Ⅰ发生还原反应 电极Ⅱ逐渐溶解 电极Ⅲ的电极反应:Cu2++2e-===Cu
此装置属于电解池 此装置中的铁极、匕发生氧化反应 该电化学防护法称为“牺牲阳极阴极保护法” 该电化学防护法称为“外加电源阴极保护法”
该方法将电能转化成化学能 该方法称为“外加电流的阴极保护法” 在此装置中钢管道作正极 镁块上发生的电极反应为O2+2H2O+4e-=4OH-
电子方向:电极IV→电流计A.→电极I. 电极I.的电极反应:Al - 3e- = Al3+ 电极Ⅱ发生氧化反应 右池中的Cu2+向电极Ⅲ移动
电子移动:电极Ⅰ→电极Ⅳ→电极Ⅲ→电极Ⅱ 电极Ⅰ发生还原反应 电极Ⅳ逐渐溶解 电极Ⅲ的电极反应:Cu-2e-=Cu2+
化学/化学 化学/电化学 电化学/化学 电化学/电化学
电流方向:电极Ⅳ→A→电极Ⅰ 电极Ⅰ发生还原反应 电极Ⅱ逐渐溶解 电极Ⅲ的电极反应:Cu2++2e-===Cu
甲装置是电解池,乙装置是原电池 当甲中产生0.1 mol气体时,乙中析出固体的质量为6.4 g 实验一段时间后,甲烧杯中溶液的pH减小 将乙中的C.电极换成铜电极,则乙装置可变成电镀装置
图Ⅰ所示电池中,MnO2的作用是催化剂 图Ⅱ所示电池放电过程中,硫酸浓度不断增大 图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变 图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中被还原为Ag
电极Ⅰ发生还原反应 电流方向:电极Ⅳ→A→电极Ⅰ 电极Ⅱ逐渐溶解 电极Ⅲ的电极反应:Cu2++2e-===Cu
电流方向:电极IV→ →电极I. 电极I.发生还原反应 电极II逐渐溶解 电极III的电极反应:Cu2++2e-==Cu
→电极I. 电极I.发生还原反应 电极II逐渐溶解 电极III的电极反应:Cu2++2e-==Cu
电子移动:电极Ⅰ→电极Ⅳ→电极Ⅲ→电极Ⅱ 电极Ⅰ发生还原反应 电极Ⅳ逐渐溶解 电极Ⅲ的电极反应:Cu-2e-===Cu2+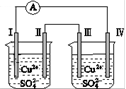
化学/化学 化学/电化学 电化学/化学 电化学/电化学
a和b用导线连接,电子由碳经过导线流向铁 a和b用导线连接,铁电极的电极反应为:Fe﹣3e﹣=Fe3+ a、b分别连接直流电源正、负极,可以防止铁被腐蚀 a、b分别连接直流电源负、正极,电压足够大时,Na+向铁电极 移动
电流方向:电极Ⅳ→A→电极Ⅰ
电极Ⅰ发生还原反应 电极Ⅱ逐渐溶解
电极Ⅲ的电极反应:Cu2+ + 2e- = Cu
由可见电极的宏观电池引起的 电化学腐蚀过程中不产生电流 电化学腐蚀将使阳极金属不断被腐蚀 电化学腐蚀分别在阴阳极发生还原和氧化反应
电子移动:电极Ⅰ→电极Ⅳ→电极Ⅲ→电极Ⅱ 电极Ⅰ发生还原反应 电极Ⅳ逐渐溶解 电极Ⅲ的电极反应:Cu-2e-===Cu2+

 →电极I. 电极I.发生还原反应 电极II逐渐溶解 电极III的电极反应:Cu2++2e-==Cu
→电极I. 电极I.发生还原反应 电极II逐渐溶解 电极III的电极反应:Cu2++2e-==Cu
