你可能感兴趣的试题
在101kPa,1mol物质燃烧生成氧化物时所放出的热量叫做该物质的燃烧热 在稀溶液里,任何酸碱之间发生中和反应放出的热量都是57.3KJ/mol 在化学反应过程中放出或吸收的热量通常叫做反应热 N2(g)+3H2(g)===NH3(g);△H=-92.38KJ/mol指反应建立平衡时放出的热量为92.38KJ/mol
酸和碱发生中和反应生成水,这时的反应热叫中和热 燃烧热或中和热是反应热的种类之一 在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 在稀溶液中,1molCH3COOH和1mol NaOH完全中和时放出的热量为57.3kJ
当△H.为“一”时,表示该反应为吸热反应 已知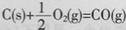 的反应热为l10.5kJ/mol,说明碳的燃烧热为110.5kJ/mol 反应热的大小取决于反应物所具有总能量和生成物所具有总能量的相对大小 反应热不但与反应体系的始态和终点状态有关,而且与反应的途径也有关
的反应热为l10.5kJ/mol,说明碳的燃烧热为110.5kJ/mol 反应热的大小取决于反应物所具有总能量和生成物所具有总能量的相对大小 反应热不但与反应体系的始态和终点状态有关,而且与反应的途径也有关
在化学反应过程中所放出或吸收的热量称为反应热 在稀溶液中,1mol酸跟1mol碱发生中和反应所放出的热量叫做中和热 对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量 在101kPa,1mol物质完全燃烧生成稳定氧化物时所放出的热量叫做该物质的燃烧热
在101 kPa时,1 mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 酸和碱发生中和反应生成1 mol水,这时的反应热叫中和热 燃烧热和中和热是反应热的种类之一 在稀溶液中,1 mol乙酸和1 mol氢氧化钠完全中和时放出的热量为57.3 kJ
在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 酸和碱发生中和反应生成1mol水,这时的反应热叫中和热 燃烧热或中和热是反应热的种类之一 在稀溶液中,1molCH3COOH和1mol NaOH完全中和时放出的热量为57.3kJ
1mol物质燃烧放出的热量称为燃烧热 放热反应的反应热符号为“-” 1mol碱与1mol酸反应放出的热量等于57.3kJ 吸热反应必须加热才能发生
放热反应中的反应热(△H )为正值 CO的燃烧热是-283.0 kJ· ,则2CO2(g)
,则2CO2(g)  2CO(g)+O2(g)反应的 △H=2×283.0 kJ·
2CO(g)+O2(g)反应的 △H=2×283.0 kJ· 1mol甲烷燃烧生成水蒸气和二氧化碳所放出的热量是甲烷的燃烧热 HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
1mol甲烷燃烧生成水蒸气和二氧化碳所放出的热量是甲烷的燃烧热 HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量 任何放热反应在常温条件下一定能发生反应 在稀溶液中,酸跟碱发生中和反应生成1molH2O时的反应热叫做中和热 在101kPa,1mol物质完全燃烧生成稳定氧化物时所放出的热量就叫做该物质的燃烧热
在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 酸和碱发生中和反应生成1mol水,这时的反应热叫中和热 燃烧热或中和热都是反应热的种类之一 其他条件一样时,氢气与氧气反应生成液态水和气态水时所放出的热量相等
CO(g)的燃烧热283.0 kJ·mol-1,则2CO2(g) = 2CO(g)+O2(g)反应的ΔH.=+2×283.0 kJ·mol-1 HCl和NaOH反应的中和热ΔH.=-57.3 kJ·mol-1,则H2SO4和Ca(OH) 2反应的中和热ΔH.=2×(-57.3)kJ·mol-1 反应热有正负之分,燃烧热ΔH.全部是正值 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
甲烷的燃烧热 ∆H= -890.3KJ 炭生成一氧化碳的燃烧热是111KJ/mol 中和热 ∆H= -57.3KJ/mol 醋酸与NaOH反应的中和热小于-57.3KJ/mol
在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 酸和碱发生中和反应生成1mol水,这时的反应热叫中和热
燃烧热或中和热是反应热的种类之一 吸热反应没有利用价值
活化能的大小对化学反应前后的能量变化不产生影响 化学键的断裂和形成是物质在化学变化中发生能量变化的主要原因 盐酸和NaOH(aq)反应的中和热△H=-57.3kJ/mol,则H2SO4(aq)和Ca(OH)2(aq)反应的中和热△H=2×(-57.3)kJ/mol CO(g)的燃烧热是283.0kJ/mol,则反应2CO2(g)=2CO(g)+O2(g)的反应热△H= +2 x283.0kJ/mol
在化学反应进行的过程中放出或吸收的热量称为反应热。
在稀溶液中,1mol酸跟1mol碱发生中和反应所放出的热量叫做中和热。
对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量。
在101Kpa时,1mol物质完全燃烧生成稳定氧化物时,所放出的热量叫做该物质的燃烧热。
HCl和NaOH反应的中和热△H.=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热 △H.=2×(-57.3)kJ/mol CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)= 2CO(g)+O2(g)的△H.=+566.0kJ/mol 需要加热才能发生的反应一定是吸热反应 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
已知下列热化学方程式:2H2(g)+O2(g) === 2H2O(g) △H.=-484kJ•mol-1, 则氢气的燃烧热为242kJ•mol-1 中和反应的实质是H+ 与OH-结合生成水,若有其它物质生成,这部分反应热不在中和热内 物质的燃烧热可利用仪器由实验测得 中和热不包括物质溶解、电离、水合等过程中的热效应
沼气是可再生能源 燃烧热和中和热都属于反应热 电能是一级能源 氧化还原反应可能是吸热反应也可能是放热反应

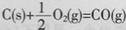 的反应热为l10.5kJ/mol,说明碳的燃烧热为110.5kJ/mol 反应热的大小取决于反应物所具有总能量和生成物所具有总能量的相对大小 反应热不但与反应体系的始态和终点状态有关,而且与反应的途径也有关
的反应热为l10.5kJ/mol,说明碳的燃烧热为110.5kJ/mol 反应热的大小取决于反应物所具有总能量和生成物所具有总能量的相对大小 反应热不但与反应体系的始态和终点状态有关,而且与反应的途径也有关
 ,则2CO2(g)
,则2CO2(g)  2CO(g)+O2(g)反应的 △H=2×283.0 kJ·
2CO(g)+O2(g)反应的 △H=2×283.0 kJ· 1mol甲烷燃烧生成水蒸气和二氧化碳所放出的热量是甲烷的燃烧热 HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
1mol甲烷燃烧生成水蒸气和二氧化碳所放出的热量是甲烷的燃烧热 HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol