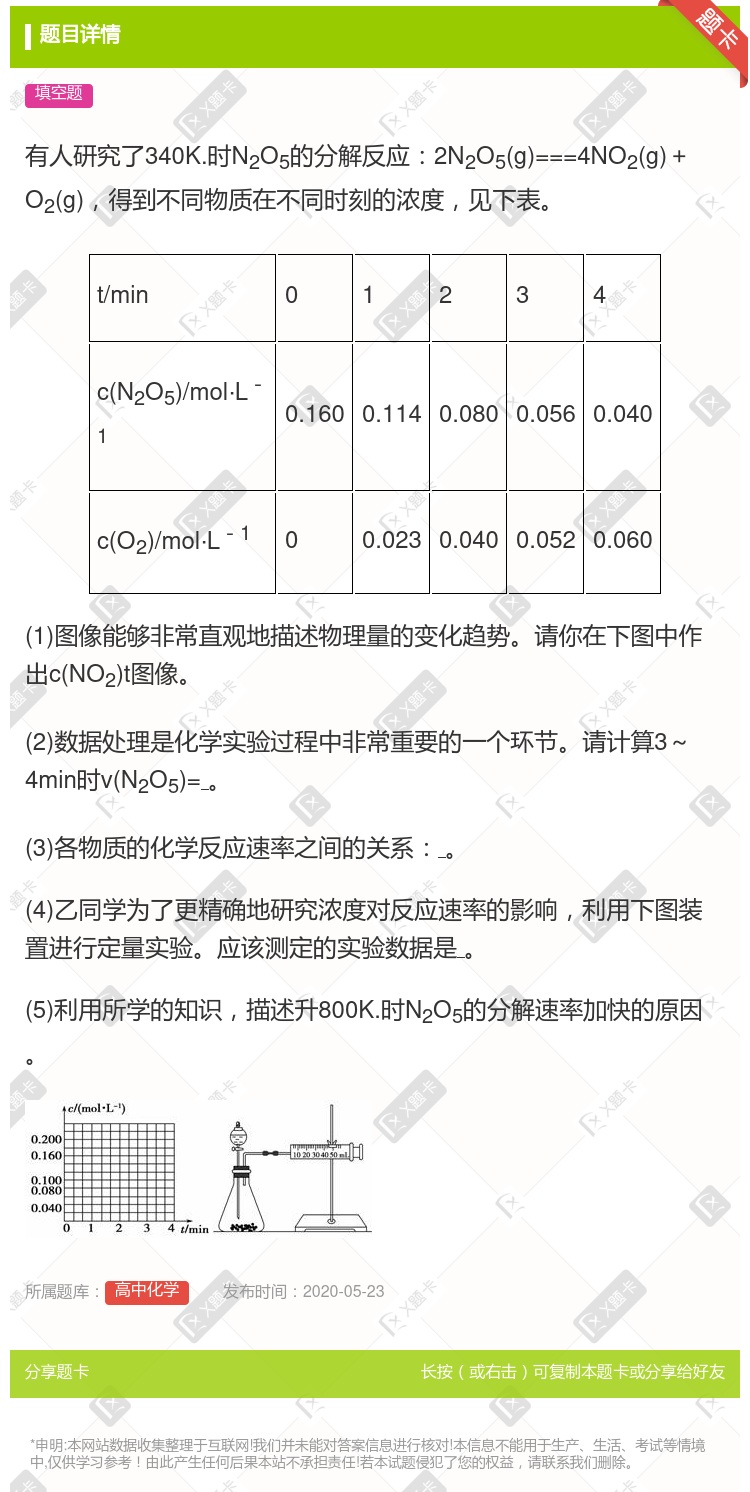
你可能感兴趣的试题
340K时,速率方程式中的m = 1 340K时,速率方程式中的k = 0.350 min-1 340K时,c(N2O5)= 0.100 mol·l-1时,v = 0.035 mol·l-1 ·min-1 340K时,压强增大一倍,逆反应速率不变,正反应速率是原来的2倍
常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2) 常温下,水分解产生O2,此时平衡常数的数值约为5×10-80 常温下,NO、H2O、CO2三种物质分解放出O2的倾向由大到小的顺序为 NO>H2O>CO2 以上说法都不正确
l:l:l:l 1:2:3:5:4 1:2:1:4:5 5:4:3:1:2
500 s内N2O5分解速率为2.96×10-3 mol/(L·s) T1温度下的平衡常数为K1=125,1 000 s时转化率为50% 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T12 T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2
18O仅存在于O2中 18O不可能存在于N2O中 18O可存在于以上各物质中 18O仅可能存在于N2O3,N2O5中
500 s内N2O5分解速率为2.96×10-3mol·L-1·s-1 T.1温度下的平衡常数K.1=125,平衡时N2O5的转化率为50% T.1温度下的平衡常数为K.1,T.2温度下的平衡常数为K.2,若T.1>T.2,则K.1<K.2 达到平衡后其他条件不变,将容器的体积压缩到原来的 ,则再次平衡时c(N2O5)>5.00 mol·L-1
,则再次平衡时c(N2O5)>5.00 mol·L-1
常温下,NO分解产生O2的反应平衡常数表达式为K1=[N2][O2] 常温下,水分解产生O2,此时平衡常数的数值约为5×10﹣80 常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2 以上说法都不正确
T.温度下该反应的平衡常数为K=125 500s内N2O5分解速率为2.96×10-3 mol/(L·s) T.温度下的平衡常数为K.,若T1温度下的平衡常数为K1,且K>K1,则T>T1 其他条件不变时,T1温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,则T1
500 s内N2O5分解速率为2.96×10-3 mol/(L·s) T1温度下的平衡常数为K1=125,1 000 s时转化率为50% 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T12 T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2
0~20 s内平均反应速率v(N2O5)=0.1 mol·(L·s)-1 10 s时,正、逆反应速率相等,达到平衡 20 s时,正反应速率大于逆反应速率 曲线a表示NO2的物质的量随反应时间的变化
 ,则再次平衡时c(N2O5)>5.00 mol·L-1
,则再次平衡时c(N2O5)>5.00 mol·L-1