你可能感兴趣的试题
通氧气的铂极为负极 此电池反应为CH4+2O2=CO2+2H2O 此电池放电时,KOH浓度减小 此电池放电时,KOH浓度不变
通入CH4的电极为负极 正极发生氧化反应 燃料电池工作时,溶液中的OH-向负极移动 该电池使用一段时间后应补充KOH
电池放电过程中,溶液pH不断升高 每消耗1molCH4可以向外电路提供8mole- 负极上O2获得电子,电极反应式为 O2+2H2O+4e-=4OH- 正极上CH4失去电子,电极反应式CH4+10OH-―8e-=CO32-+7H2O
通入甲烷的电极为电池的正极,通入氧气的电极为负极 在标准状况下,每消耗5.6L. O2,可向外提供9.6×104 C的电量 通入甲烷电极的电极反应为:CH4+10OH― ― 8e-=== CO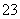 + 7H2O 放电一段时间后,溶液pH升高
+ 7H2O 放电一段时间后,溶液pH升高
通甲烷的一极为负极,通氧气的一极为正极 放电时通入氧气的一极附近溶液的pH升高 放电一段时间后,KOH的物质的量不发生变化 通甲烷的电极反应式是:CH4+10OH --8e-==CO32-+7H2O
通入CH4的电极为正极 该电池使用一段时间后无需补充KOH 燃料电池工作时,溶液中的OH-向正极移动 负极发生氧化反应
每消耗1molCH4可以向外电路提供4mole- 在负极上O2获得电子,电极反应式为 O2+2H2O+4e-=4OH- 外电路电子由负极流向正极,内电路电子由正极流向负极 电池放电过程中,溶液的PH不断降低
每消耗1molCH4 可以向外电路提供4mole- 电池放电后,溶液PH不断升高 负极上O2得到电子,电极反应式为:O2+2H2O+4e-=4OH- 负极上CH4失去电子,电极反应式: CH4+10OH--8e-=CO32-+7H2O
通入CH4的电极为负极 正极发生氧化反应 燃料电池工作时溶液中的阴离子向负极移动 该电池使用一段时间后应补充KOH

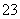 + 7H2O 放电一段时间后,溶液pH升高
+ 7H2O 放电一段时间后,溶液pH升高