你可能感兴趣的试题
质子数为17、中子数为20的氯原子: 氯离子(Cl-)的结构示意图:
氯离子(Cl-)的结构示意图: 氯分子的电子式:
氯分子的电子式: 氯乙烯分子的结构简式:H3C-CH2Cl
氯乙烯分子的结构简式:H3C-CH2Cl
在NaCl和HCl里,氯元素均为–1价 在H2中,氢元素显+1价 一种元素在同一种化合物里,可能显不同的化合价 非金属元素在化合物里,一定显负价
非金属都是绝缘体 有一定熔点的固体都是晶体 含有氧元素的化合物都是氧化物 含有碳元素的化合物都是有机化合物
质子数为17、中子数为20的氯原子: 氯离子(Cl-)的结构示意图:
氯离子(Cl-)的结构示意图: 氯分子的电子式:
氯分子的电子式: 氯乙烯分子的结构简式: CH3-CH2Cl
氯乙烯分子的结构简式: CH3-CH2Cl
质子数为17、中子数为20的氯原子: 氯离子(Cl-)的结构示意图:
氯离子(Cl-)的结构示意图: 氯分子的电子式:
氯分子的电子式: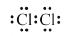 氯乙烯分子的结构简式:H3C-CH2Cl
氯乙烯分子的结构简式:H3C-CH2Cl
ⅠA.族与ⅦA.族元素间可形成共价化合物或离子化合物 第二周期元素从左到右,最高正价从+1递增到+7 同主族元素的简单阴离子还原性从上到下依次减弱 同周期金属元素的化合价越高,其原子失电子能力越强
IA族与VIIA族元素间可形成共价化合物或离子化合物 第二周期元素从左到右,最高正价从+1递增到+7 同主族元素的简单阴离子还原性越强,其非金属的氧化性越强 同周期金属元素的化合价越高,其原子失电子能力越强
质子数为17、中子数为20的氯原子: 氯离子(Cl-)的结构示意图:
氯离子(Cl-)的结构示意图: 氯分子的电子式:
氯分子的电子式: 氯乙烯分子的结构简式:H3C-CH2Cl
氯乙烯分子的结构简式:H3C-CH2Cl
质子数为17、中子数为20的氯原子: 氯离子(Cl-)的结构示意图:
氯离子(Cl-)的结构示意图: 氯分子的电子式:
氯分子的电子式: 氯乙烯分子的结构简式:H3C-CH2Cl
氯乙烯分子的结构简式:H3C-CH2Cl
IA族与ⅦA族元素间可形成共价化合物或离子化合物 第二周期元素从左到右,最高正价从+1递增到+7 同主族元素的简单阴离子还原性越强,水解程度越大 同周期金属元素的化合价越高,其原子失电子能力越强
IA族与ⅦA族元素间形成的化合物都是离子化合物 第三周期元素从左到右,最高正价从+1递增到+7 同主族元素的简单阴离子从上到下还原性减弱 同周期金属元素的化合价越高,其原子失电子能力越强
IA族与ⅦA.族元素间可形成共价化合物或离子化合物
第二周期元素从左到右,最高正价从+1递增到+7
同主族元素的简单阴离子还原性越强,对应单质的氧化性也越强 同周期金属元素的化合价越高,其原子失电子能力越强
同周期金属元素的化合价越高,其原子失电子能力越强 第二周期元素从左到右,最高正价从+1递增到+7 同主族元素的简单阴离子还原性越强,则该元素对应的气态氢化物稳定性越强 IA族与VIIA族元素间可形成共价化合物或离子化合物
ⅠA.族与ⅦA.族元素间可形成共价化合物或离子化合物 第二周期元素从左到右,最高正价从+1递增到+7 同主族元素的简单阴离子还原性越强,半径越小 同周期金属元素的化合价越高,其原子失电子能力越强
质子数为17、中子数为20的氯原子:2017Cl 氯离子(Cl-)的结构示意图:
氯分子的电子式: 氯乙烯分子的结构简式CH3-CH2Cl
质子数为17、中子数为20的氯原子: Cl 四氯化碳分子的比例模型:
Cl 四氯化碳分子的比例模型: 氯分子的电子式:
氯分子的电子式: 氯乙烯分子的结构简式:H3C﹣CH2Cl
氯乙烯分子的结构简式:H3C﹣CH2Cl
IA族与VIIA族元素间可形成共价化合物或离子化合物 最高第二周期元素从左到右,正价从+1递增到+7 同主族元素的简单阴离子还原性越强,水解程度越大 同周期金属元素的化合价越高,其原子失电子能力越强
在NaCl和HClO里,氯元素均为﹣1价 在H2中,氢元素显+1价 在化合物中正负化合价的代数和为零 非金属元素在化合物里,一定显负价
在NaCl和HCl里,氯元素均为-1价 在H2中,氢元素显+1价 一种元素在同一种化合物里,一定显相同的化合价 非金属元素在化合物里,一定显负价
液氯是纯净物,而氯水是电解质,漂白粉是混合物 氯气可用作消毒剂和漂白剂,是因为氯分子具有强氧化性 随着化合价的升高,氯的含氧酸酸性和氧化性均逐渐增强 氯化铝受热易升华,加压下加热得到熔融氯化铝不导电,故氯化铝是共价化合物

 氯离子(Cl-)的结构示意图:
氯离子(Cl-)的结构示意图: 氯分子的电子式:
氯分子的电子式: 氯乙烯分子的结构简式:H3C-CH2Cl
氯乙烯分子的结构简式:H3C-CH2Cl
 氯离子(Cl-)的结构示意图:
氯离子(Cl-)的结构示意图: 氯分子的电子式:
氯分子的电子式: 氯乙烯分子的结构简式: CH3-CH2Cl
氯乙烯分子的结构简式: CH3-CH2Cl
 氯离子(Cl-)的结构示意图:
氯离子(Cl-)的结构示意图: 氯分子的电子式:
氯分子的电子式: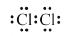 氯乙烯分子的结构简式:H3C-CH2Cl
氯乙烯分子的结构简式:H3C-CH2Cl
 氯离子(Cl-)的结构示意图:
氯离子(Cl-)的结构示意图: 氯分子的电子式:
氯分子的电子式: 氯乙烯分子的结构简式:H3C-CH2Cl
氯乙烯分子的结构简式:H3C-CH2Cl
 Cl 四氯化碳分子的比例模型:
Cl 四氯化碳分子的比例模型: 氯分子的电子式:
氯分子的电子式: 氯乙烯分子的结构简式:H3C﹣CH2Cl
氯乙烯分子的结构简式:H3C﹣CH2Cl