你可能感兴趣的试题
Ca(NO3)2 Na2CO3 NaNO3 K2CO3
0.05mol·L-1的AgN03溶液 0.05mol·L-1的CaCl2溶液 0.01mol·L-1的NaCl溶液 纯水
x的数值为2×10-5 c点时有碳酸钙沉淀生成 b点与d点对应的溶度积相等 加入蒸馏水可使溶液由d点变到a点
x数值为2×10-5 c点时有碳酸钙沉淀生成 加入蒸馏水可使溶液由d 点变到a点 b点与d对应的溶度积相等
除去锅炉水垢中硫酸钙的办法是将其转化为碳酸钙,然后用酸去除 图中b点碳酸钙的结晶速率小于其溶解速率 通过蒸发,可使溶液由a点变化到c点 在25℃时,反应CaSO4(s)+CO32-(aq)===CaCO3(s)+SO42-(aq)的平衡常数K=3500
25℃时,将20g甲固体加入到50g水中,充分溶解并恢复到原温度可形成70 g溶液 甲是三种物质中溶解度最大的 将35℃时丙的饱和溶液降温到25℃,则其溶液的溶质质量分数不变 35℃时,甲物质饱和溶液的溶质质量分数为40% 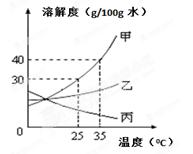
x数值为2×10-5 c点时有碳酸钙沉淀生成 加入蒸馏水可使溶液由d点变到a点 b点与d点对应的溶度积相等
x数值为2×10-5 c点时有碳酸钙沉淀生成 加入蒸馏水可使溶液由d点变到a点 b点与d点对应的溶度积相等
CaCO3(s) Ca2+(aq)+ CO32-(aq) ΔH.<0 a、b、chtt|、d四点对应的溶度积K.spht相等 温度不变,蒸发水,可使溶液由a点变到cht|点 25 ℃时,CaCO3的K.sp=2.8×10-9
Ca2+(aq)+ CO32-(aq) ΔH.<0 a、b、chtt|、d四点对应的溶度积K.spht相等 温度不变,蒸发水,可使溶液由a点变到cht|点 25 ℃时,CaCO3的K.sp=2.8×10-9
一定有CaCO3和Ca(OH)2 一定有Ca(OH)2,可能有CaCO3 一定没有CaCO3和Ca(OH)2 一定有CaCO3,可能有Ca(OH)2
由甲图可知,氯化钠在40℃时的溶解度为36.6g 由乙可知,硝酸钾在水中的溶解度随温度的升高而增大 比较甲乙可知,可采用蒸发结晶来提纯混有少量氯化钠的硝酸钾晶体 比较甲乙可知,相同温度下影响固体溶质溶解度的因素是溶质的性质
加入蒸馏水可使溶液由d点变到a点 c点时有碳酸钙沉淀生成 x数值为2×10-5 b点与d点对应的溶度积相等
20°C.时,NaCl的溶解度为31.6g KNO3的溶解度大于NaCl的溶解度 使NaCl从其饱和溶液中析出,可采用蒸发溶剂的方法 50℃时,在100g水中加入100gKNO3,所得溶液中KNO3的质量分数为50%


 Ca2+(aq)+ CO32-(aq) ΔH.<0 a、b、chtt|、d四点对应的溶度积K.spht相等 温度不变,蒸发水,可使溶液由a点变到cht|点 25 ℃时,CaCO3的K.sp=2.8×10-9
Ca2+(aq)+ CO32-(aq) ΔH.<0 a、b、chtt|、d四点对应的溶度积K.spht相等 温度不变,蒸发水,可使溶液由a点变到cht|点 25 ℃时,CaCO3的K.sp=2.8×10-9