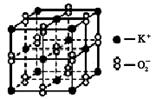
 ,每个O
,每个O 周围有8个K+ 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O
周围有8个K+ 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O 晶体中与每个K+距离最近的K+有8个 晶体中,0价氧与-2价氧的数目比为2:1
晶体中与每个K+距离最近的K+有8个 晶体中,0价氧与-2价氧的数目比为2:1
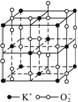
 晶体中每个K.+周围有8个O
晶体中每个K.+周围有8个O ,每个O
,每个O 周围有8个K.+ 晶体中与每个K.+距离最近的K.+有8个 晶体中与每个K.+距离最近的K.+有6个
周围有8个K.+ 晶体中与每个K.+距离最近的K.+有8个 晶体中与每个K.+距离最近的K.+有6个
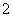 晶体中每个K.+周围有8个O
晶体中每个K.+周围有8个O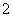 ,每个O
,每个O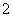 周围有8个K.+ 晶体中与每个K.+距离最近的K.+有8个 晶体中与每个K.+距离最近的K.+有6个
周围有8个K.+ 晶体中与每个K.+距离最近的K.+有8个 晶体中与每个K.+距离最近的K.+有6个
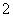 晶体中每个K.+周围有8个O
晶体中每个K.+周围有8个O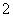 ,每个O
,每个O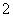 周围有8个K.+ 晶体中与每个K.+距离最近且相等的K.+有8个 晶体中0价氧与-2价氧的数目之比为5∶1
周围有8个K.+ 晶体中与每个K.+距离最近且相等的K.+有8个 晶体中0价氧与-2价氧的数目之比为5∶1
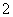 晶体中每个K.+周围有8个O
晶体中每个K.+周围有8个O ,每个O
,每个O 周围有8个K.+ 晶体中与每个K.+距离最近的K.+有8个 晶体中,0价氧原子与-2价氧原子的数目比为3∶1
周围有8个K.+ 晶体中与每个K.+距离最近的K.+有8个 晶体中,0价氧原子与-2价氧原子的数目比为3∶1