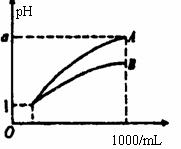
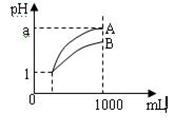
 1000ml,其pH与溶液体积V.的关系如图所示,则下列 说法不正确的是: A.两种酸溶液的物质的量浓度一定相等 稀释后,A.酸溶液的酸性比B.酸溶液弱 若a=4,则A.是强酸,B.是弱酸 若1<a<4,则A.B.都是弱酸
1000ml,其pH与溶液体积V.的关系如图所示,则下列 说法不正确的是: A.两种酸溶液的物质的量浓度一定相等 稀释后,A.酸溶液的酸性比B.酸溶液弱 若a=4,则A.是强酸,B.是弱酸 若1<a<4,则A.B.都是弱酸
 和
和 混合溶液中:
混合溶液中:  常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:
常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:  常温下
常温下 相等的①
相等的① 、②
、② 、③
、③ 三种溶液中,溶质的物质的量浓度大小:①>②>③ 等体积、等物质的量浓度的
三种溶液中,溶质的物质的量浓度大小:①>②>③ 等体积、等物质的量浓度的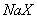 和弱酸
和弱酸 混合后呈酸性的溶液中:
混合后呈酸性的溶液中: 
 >
> 0.1 mol·L-1的NaHCO3溶液中:c(Na+)+c(H+)=c(HCO
0.1 mol·L-1的NaHCO3溶液中:c(Na+)+c(H+)=c(HCO )+2c(CO
)+2c(CO )+c(OH-) 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
)+c(OH-) 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
 用水稀释该溶液,OH-的物质的量增加 该溶液中共有6种微粒 上述溶液中再加入V. mL水后,所得溶液溶质的质量分数大于0.5w
用水稀释该溶液,OH-的物质的量增加 该溶液中共有6种微粒 上述溶液中再加入V. mL水后,所得溶液溶质的质量分数大于0.5w
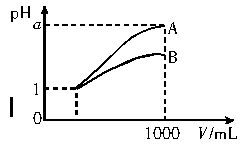 A.A.B两种酸溶液的物质的量浓度一定相等
A.A.B两种酸溶液的物质的量浓度一定相等 A.A. 两种酸溶液的物质的量浓度一定相等B.稀释后,A.酸溶液的酸性比B.酸溶液弱 若a=4,则A.是强酸,B.是弱酸 若1
A.A. 两种酸溶液的物质的量浓度一定相等B.稀释后,A.酸溶液的酸性比B.酸溶液弱 若a=4,则A.是强酸,B.是弱酸 若1