你可能感兴趣的试题
0 0.1 mol.L-1 10-7 mol.L-1 10-13 mol.L-1
1.0×10-7 mol•L-1 1.0×10-6 mol•L-1 1.0×10-2 mol•L-1 1.0×10-12 mol•L-1
5×10-13mol/L 0.01 mol/L 1×10-7 mol/L 1×10-12mol/L
甲、乙两溶液的pH不可能相同 甲、乙两种溶液中加入Al粉都一定会产生H2 HCO3-不可能在甲、乙两溶液中大量共存 甲不可能是盐溶液,乙不可能是酸或碱溶液
甲、乙两溶液的pH不可能相同 甲、乙两种溶液中加入Al粉都会产生H2 HCO 不可能在甲、乙两溶液中大量共存 甲不可能是盐溶液,乙不可能是酸或碱溶液
不可能在甲、乙两溶液中大量共存 甲不可能是盐溶液,乙不可能是酸或碱溶液
溶液中水电离出的c(H+)=10-10 mol/L 溶液中c(H+)+c(A-)=0.1 mol/L 溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大 与0.05mol/L NaOH溶液等体积混合后所得溶液中离子浓度大小关系为 c(A-)>c(Na+)>c(OH-)>c(H+)
该溶液1 mL稀释至100 mL后,pH等于2 向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和 该溶液中硝酸电离出的c(H.+)与水电离出的c(H.+)之比值为10-12 该溶液中水电离出的c(H.+)是pH为3的硝酸中水电离出的c(H.+)的100倍
a点溶液中:水电离出的c(H+)=1×10-10mol/L b点溶液中:c(H+)=1×10-7mol/L c点溶液中:c(Na+)>c(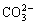 )>c(
)>c( ) d点溶液中:c(Na+)=2c(
) d点溶液中:c(Na+)=2c(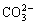 )+c(
)+c( )
)
0.02mol/L 1×10-7mol/L 5×10-13mol/L 1×10-12mol/L
在有AgCl沉淀的溶液中加入NaC1固体,c(Ag+)减小 室温下100mL pH=13的Ba(OH)2溶液中OH-的物质的量为0.02mol 稀释0.1 mol /L的NH3·H2O溶液,溶液中所有离子浓度均减小 溶液中水电离出c(H+)和水电离出的c(OH-)的乘积一定等于10-14
呈碱性 呈酸性 呈中性 [OH-]=1 000[H+]
物质的量浓度相同的①CH3COONH4 ②NH4Cl ③(NH4)2Fe(SO4 )2三种溶液中C.(NH4+):③>②>① 将0.1mol/L醋酸钠溶液加水稀释或加入少量醋酸钠晶体时,都会使溶液中 (H+)减小 C. 室温下,pH=5的醋酸和氯化铵溶液,由水电离出的C.(H+)=1×10-5 任何条件下,任何物质的水溶液中都有H+和OH-,且KW=1×10-14
该溶液1 mL稀释至100 mL后,pH大于3 向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和 该溶液中硝酸电离出的[H+]与水电离出的[H+]的比值为10-12 该溶液中水电离出的[H+]是pH为3的硝酸中水电离出的[H+]的100倍
甲、乙两溶液的pH不可能相同 甲、乙两种溶液中加入Al粉都一定会产生H2 HCO3-不可能在甲、乙两溶液中大量共存 甲不可能是盐溶液,乙不可能是酸或碱溶液

 不可能在甲、乙两溶液中大量共存 甲不可能是盐溶液,乙不可能是酸或碱溶液
不可能在甲、乙两溶液中大量共存 甲不可能是盐溶液,乙不可能是酸或碱溶液
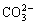 )>c(
)>c( ) d点溶液中:c(Na+)=2c(
) d点溶液中:c(Na+)=2c(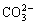 )+c(
)+c( )
)